水中溶解氧的测定--碘量法
一、实验原理
水中溶解氧的测定,一般用碘量法。在水中加入硫酸锰及碱性碘化钾溶液,生成氢氧化锰沉淀。此时氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰:
2MnSO4+4NaOH=2Mn(OH)2↓+2Na2SO4
2Mn(OH)2+O2=2H2MnO3
H2MnO3十Mn(OH)2=MnMnO3↓+2H2O
(棕色沉淀) 加入浓硫酸使棕色沉淀(MnMn02)与溶液中所加入的碘化钾发生反应,而析
出碘,溶解氧越多,析出的碘也越多,溶液的颜色也就越深。
2KI+H2SO4=2HI+K2SO4
MnMnO3+2H2SO4+2HI=2MnSO4+I2+3H2O
I2+2Na2S2O3=2NaI+Na2S4O6
用移液管取一定量的反应完毕的水样,以淀粉做指示剂,用标准溶液滴定,计算出水样中溶解氧的含量。
二、实验用品:
1、仪器:溶解氧瓶(250ml) 锥形瓶(250ml) 酸式滴定管(25ml) 移液管(50m1) 吸球
2、药品: 硫酸锰溶液 碱性碘化钾溶液 浓硫酸 淀粉溶液(1%) 硫代硫酸钠溶液(0.025mol/L)
三、实验方法
(一)水样的采集与固定
1、用溶解氧瓶取水面下20—50cm的河水、池塘水、湖水或海水,使水样充满250ml的磨口瓶中,用尖嘴塞慢慢盖上,不留气泡。
2、在河岸边取下瓶盖,用移液管吸取硫酸锰溶液1ml插入瓶内液面下,缓慢放出溶液于溶解氧瓶中。
3、取另一只移液管,按上述操作往水样中加入2ml碱性碘化钾溶液,盖紧瓶
塞,将瓶颠倒振摇使之充分摇匀。此时,水样中的氧被固定生成锰酸锰(MnMnO3)棕色沉淀。将固定了溶解氧的水样带回实验室备用。
(二)酸化
往水样中加入2ml浓硫酸,盖上瓶塞,摇匀,直至沉淀物完全溶解为止(若没全溶解还可再加少量的浓酸)。此时,溶液中有I2产生,将瓶在阴暗处放5
…… …… 余下全文

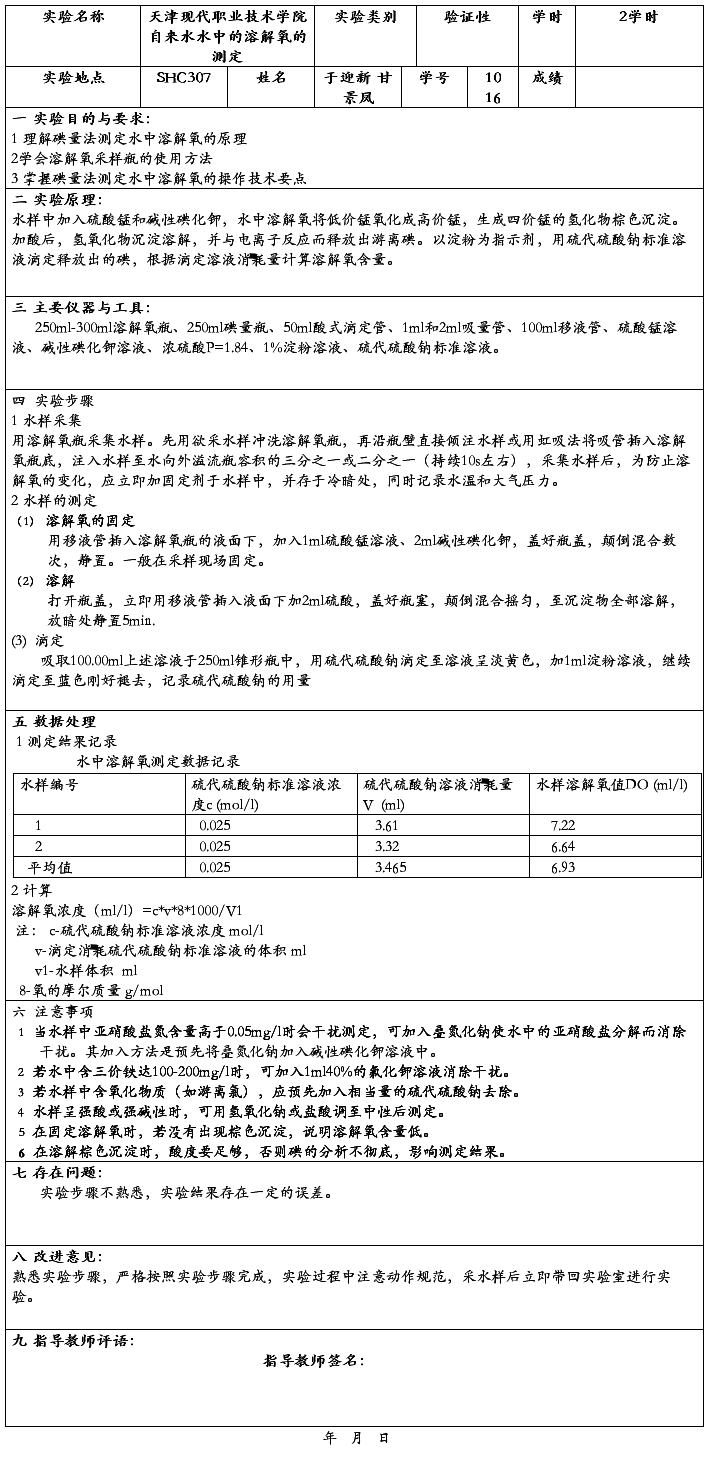
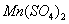 ,
,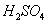 (
(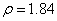 )。
)。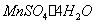 )溶于水中,稀释至100mL。此溶液加至酸化过的碘化钾溶液中,遇淀粉不得产生蓝色。
)溶于水中,稀释至100mL。此溶液加至酸化过的碘化钾溶液中,遇淀粉不得产生蓝色。 ):称取于105-110℃烘干2h并冷却的
):称取于105-110℃烘干2h并冷却的 1.226g,溶于水中,转移至1000mL容量瓶中,用水稀释至刻线,摇匀。
1.226g,溶于水中,转移至1000mL容量瓶中,用水稀释至刻线,摇匀。 ),溶于1000mL煮沸放凉的水中,加入0.2g碳酸钠。贮于棕色瓶中。在暗处放置7-14天后标定。
),溶于1000mL煮沸放凉的水中,加入0.2g碳酸钠。贮于棕色瓶中。在暗处放置7-14天后标定。