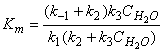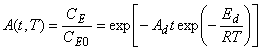实验 酶促反应动力学
————蔗糖酶米氏常数的测
【目的要求】
1.了解酶促动力学研究的范围。
2.以蔗糖酶为例,掌握测定米氏常数(Km)
【实验原理】
在酶促反应中,当反应体系的温度、pH和酶浓度恒定时,反应初速度(v)则随底物
浓度[S]的增加而加速,最后达到极限,称为最大反应速度(v)。Michaelis和Menten
根据反应速度与底物浓度的这种关系,推导出如下方程:
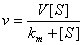
此式称为米氏方程,式中Km称为米氏常数,按此方程,可用作图法求出Km。方法有:
1.以v[S]作图
由米氏方程可知,v=V/2时,Km=[S]即米氏常数值等于反应速度达到最大反应速度一半时所需底物浓度。因此,可测定一系列不同底物浓度的反应速度v,以v对[S]作图。当v=V/2时,其相应底物浓度即为Km。
2.以1/v对1/[S]作图
取米氏方程的倒数式:


以1/v对1/[S]作图可得一直线,其斜率为Km/V,截距为1/V。若将直线延长与横轴相交,则该交点在数值上等于—l/Km。

本实验以蔗糖为底物.利用一定量蔗糖酶水解不同浓度蔗糖所形成的产物(葡萄糖和果糖)的量来计算蔗糖酶的Km值。葡萄糖和果糖能与3,5—二硝基水杨酸试剂反应,生成桔红色化合物,可于520nm处比色测定之。
【试验材料】
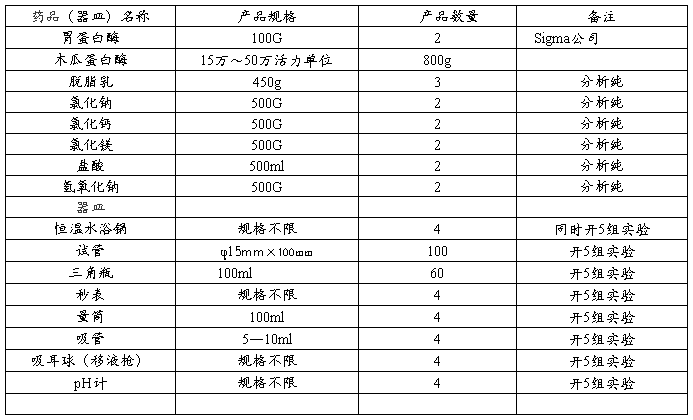
…… …… 余下全文

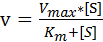 (1)
(1)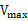 表示酶促反应最大速度,
表示酶促反应最大速度,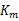 表示米氏常数。
表示米氏常数。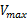 时的底物浓度[s]值即为Km值,以克分子浓度(M)表示。这种方法实际上很少采用,因为在实验条件下的底物浓度很难使酶达到饱和。实测
时的底物浓度[s]值即为Km值,以克分子浓度(M)表示。这种方法实际上很少采用,因为在实验条件下的底物浓度很难使酶达到饱和。实测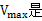 一个近似值,因而1/2
一个近似值,因而1/2
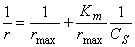 ,以
,以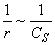 作图,将得一直线,直线截距为
作图,将得一直线,直线截距为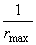 ,斜率为
,斜率为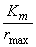 ,据此计算
,据此计算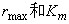 。此法由于采用两个独立变量
。此法由于采用两个独立变量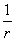 和
和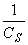 ,底物浓度很低时,反应速率也很低,取倒数,误差较大。
,底物浓度很低时,反应速率也很低,取倒数,误差较大。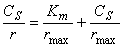 ,以
,以 作图,将得一直线,直线截距为
作图,将得一直线,直线截距为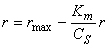 ,以
,以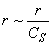 作图,将得一直线,直线截距为
作图,将得一直线,直线截距为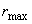 ,斜率为
,斜率为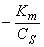 ,据此计算
,据此计算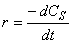 ,在CS~t的关系曲线上求取相应各点切线的斜率,才能确定不同时间的反应速率r。这种求取动力学参数的方法又称之为微分法。显然,用这种微分法作图求取反应速率会带来较大的误差。
,在CS~t的关系曲线上求取相应各点切线的斜率,才能确定不同时间的反应速率r。这种求取动力学参数的方法又称之为微分法。显然,用这种微分法作图求取反应速率会带来较大的误差。
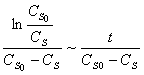 作图,将得一直线,直线斜率为
作图,将得一直线,直线斜率为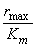 ,截距为
,截距为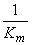 。因此直接采用动力学实验中测得的时间t、底物浓度CS数据作图,即可求取动力学参数值。
。因此直接采用动力学实验中测得的时间t、底物浓度CS数据作图,即可求取动力学参数值。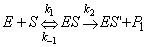
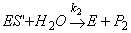

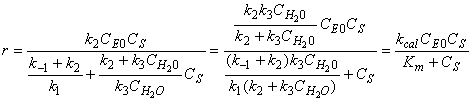
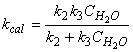 ,
,