实验五 蒸馏和沸点的测定
一、实验目的
1、了解沸点测定的原理和意义;
2、掌握常量法测定沸点的原理、方法和操作。
二、实验原理
1、蒸馏的概念,分类。
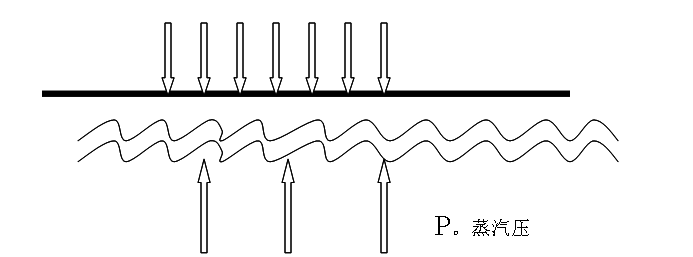
2、沸点的定义。
沸程的概念。
影响因素:外压,纯度等。
3、蒸馏的用途:⑴ 鉴定有机物,初步检验纯度。
⑵ 分离提纯挥发性物质,回收溶剂,浓缩溶液等。
注:共沸混合物有固定的沸点。
4、测定方法:⑴毛细管法(微量法);⑵蒸馏法(常量法)。
三、物理常数
表1 工业酒精主要成份的物理常数

四、主要仪器规格
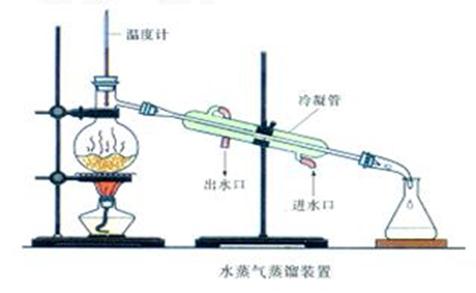
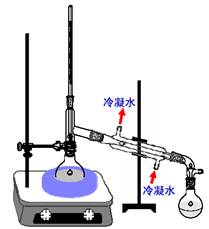
升降台 木板 电炉 水浴锅 圆底烧瓶(100mL、19#) 蒸馏头(19#) 螺帽接头(温度计套管19#) 温度计(100℃) 直形冷凝管(19#) 真空接引管(19#) 锥形瓶(100mL、19#) 量筒(10 mL、100mL) 三角漏斗 橡皮管等。
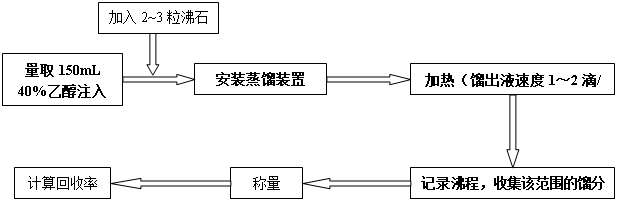
五、主要试剂用量
沸石(2~3粒) 工业酒精(45mL) 水(10mL)。
六、实验装置
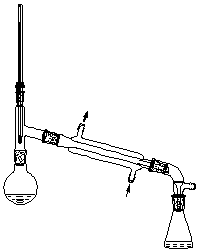

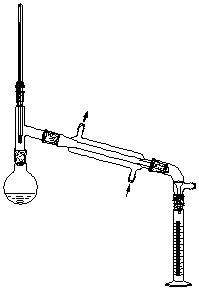
七、操作步骤
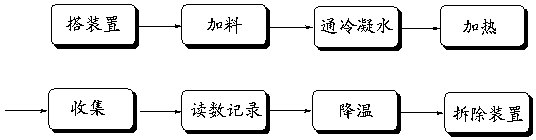
【操作要点】
⑴ 装置:仪器的选用,搭配顺序,各仪器高度位置的控制。
⑵ 加料:沸石、漏斗的选用,加料量与烧瓶体积的关系。
⑶ 通冷凝水:冷凝管的选用,水流方向。
⑷ 加热:热源的选择,防暴沸,温度的控制。
⑸ 收集:低沸点、易燃、有害物的收集装置,收集速度。
⑹ 读数:温度计、量筒的读数与有效数字。
⑺ 降温:为何不能蒸干?如何降温?
⑻ 拆除装置:顺序。
八、实验结果
…… …… 余下全文




 液体物质在大气压下和一定温度下存在气液平衡
液体物质在大气压下和一定温度下存在气液平衡