实验八十四 固体在溶液中的吸附
一、实验目的
(1)测定活性炭在醋酸水溶液中对醋酸的吸附作用,并由此计算活性炭的比表面;
(2)验证弗罗因德利希(Freundlich)经验公式和兰格缪尔(Langmuir)吸附公式;
(3)了解固-液界面的分子吸附。
二、实验原理
对于比表面很大的多孔性或高度分散的吸附剂,象活性炭和硅胶等,在溶液中有较强的吸附能力。由于吸附剂表面结构的不同,对不同的吸附质有着不同的相互作用,因而吸附剂能够从混合溶液中有选择地把某一种溶质吸附。根据这种吸附能力的选择性,在工业上有着广泛的应用,如糖的脱色提纯等
吸附能力的大小常用吸附量Г表示之。Г通常指每克吸附剂吸附溶质的物质的量,在恒定温度下,吸附量与溶液中吸附质的平衡浓度有关,弗罗因德利希(Freundlich)从吸附量和平衡浓度的关系曲线,得出经验方程:
 (1)
(1)
式中:x为吸附溶质的物质的量,单位为mol;m为吸附剂的质量,单位为g;c为平衡浓度,单位为mol·L-1;k,n为经验常数,由温度、溶剂、吸附质及吸附剂的性质决定(n一般在0.1-0.5之间)。
将(1)式取对数:
lgГ = lg =
=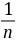 lgc +lgk (2)
lgc +lgk (2)
以lgГ对lgc作图可得一直线,从直线的斜率和截距可求得n和k。(1)式纯系经验方程式,只适用于浓度不太大和不太小的溶液。从表面上看,k为c=1时的Г,但这时(1)式可能已不适用。一般吸附剂和吸附质改变时,n改变不大,而k值则变化很大。
兰格缪尔(Langmuir)根据大量实验事实,提出固体对气体的单分子层吸附理论,认为固体表面的吸附作用是单分子层吸附,即吸附剂一旦被吸附质占据之后,就不能再吸附。固体表面是均匀的,各处的吸附能力相同,吸附热不随覆盖程度而变,被吸附在固体表面上的分子,相互之间无作用力;吸附平衡是动态平衡,并由此导出下列吸附等温式,在平衡浓度为c时的吸附量Г可用下式表示:
…… …… 余下全文

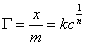 (1)
(1) (1)
(1) 吗?(B)
吗?(B) 中
中  表示什么? (D)
表示什么? (D)
