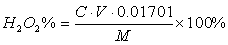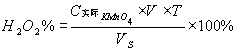高锰酸钾法测定过氧化氢含量实验报告
一、实验目的
1.了解高锰酸钾标准溶液的配制方法和保存条件。
2.掌握以Na2C2O4为基准物的标定高锰酸钾溶液浓度的方法原理及滴定条件。
3.掌握用高锰酸钾法测定H2O2含量的原理和方法。
二、实验原理
1.高锰酸钾标定原理
标定高锰酸钾的基准物有很多,常用的是Na2C2O4。在H2SO4介质中Na2C2O4与KMnO4反应,其反应式为:
2MnO4-+5C2O42-+16H+=2Mn2++5CO2↑+8H2O
2.H2O2含量测定原理
H2O2的含量可用高锰酸钾法测定。在酸性溶液中H2O2很容易被KMnO4氧化而生成有力的氧和水,其反应式为:
2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
开始反应时速度很慢,滴入第一滴KMnO4溶液时溶液不容易褪色,待生成Mn2+之后,由于Mn2+的催化,加快了反应速度,故能一直顺利地滴定到终点,根据KMnO4标准溶液的用量计算样品中H2O2的含量。
三、实验仪器及药品
仪器:铁架台、酸式滴定管、250ml锥形瓶、移液管、电热炉
药品:0.020mol/L KMnO4标准溶液、2mol/L H2SO4溶液、Na2C2O4固体、市售H2O2样品
四、实验步骤

高猛酸钾标定步骤



1. 洗涤 按要求把实验用的仪器洗涤干净。
2. 润洗 将酸式滴定管用待标定的KMnO4溶液润洗2-3次。
3. 称量 用电子称准确称取0.15-0.20g Na2C2O4基准物。
4. 溶解 将称量好的基准物置于250ml锥形瓶中,加水约20ml使之溶解,再加15ml 的2mol/L H2SO4溶液,并加热至70-85℃。
…… …… 余下全文

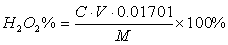
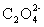 + 2
+ 2 + 16
+ 16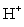 = 10
= 10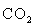 ↑ + 2
↑ + 2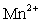 + 8
+ 8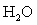
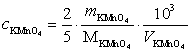 (mol/L)
(mol/L) =158.03)
=158.03)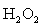 + 2
+ 2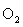 ↑ + 2
↑ + 2 (g/100mL)
(g/100mL) =34.01)
=34.01) 配制:台秤称取KMnO4 1.7~1.8 g → 500 mL试剂瓶 → 加500 mL 蒸馏水,摇匀。一周后,取上清液,弃去沉淀。
配制:台秤称取KMnO4 1.7~1.8 g → 500 mL试剂瓶 → 加500 mL 蒸馏水,摇匀。一周后,取上清液,弃去沉淀。