20##年质量管理体系内部审核报告
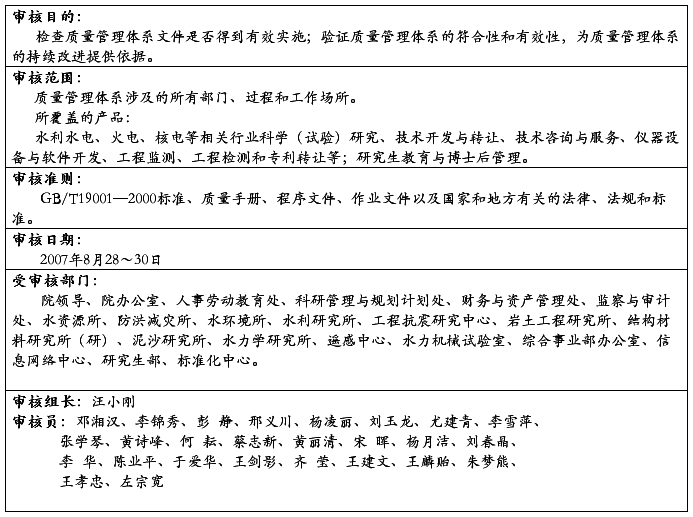
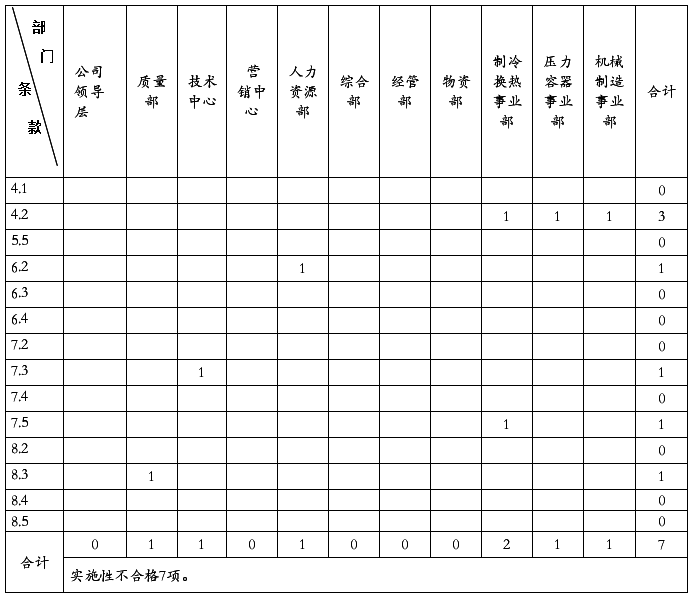
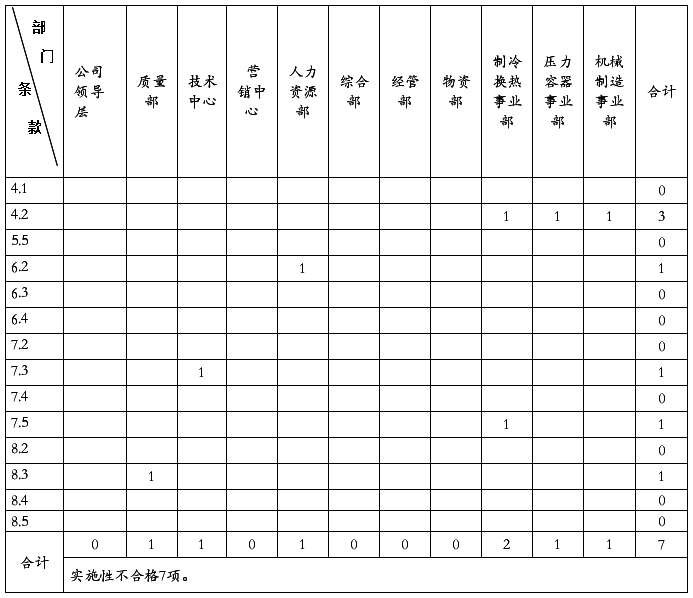
20##年4月8日至4月20日,质量管理体系内部审核组对公司质量管理体系覆盖的六个部门(含三个车间和两个仓库)进行现场审核。此次审核的目的是:评价新质量管理体系符合审核准则的适宜性和有效性。此次审核的范围:公司所有产品的设计、生产和服务所涉及的公司各部门、车间、场所和过程。此次审核的依据是:GB/T19001-2008《质量管理体系要求》,公司质量管理体系文件,适用的法律法规和顾客要求。在五天的紧张有序的审核过程中,内部审核组得到了公司及各相关部门的配合和支持,共发现不符合项2项,存在问题44个。
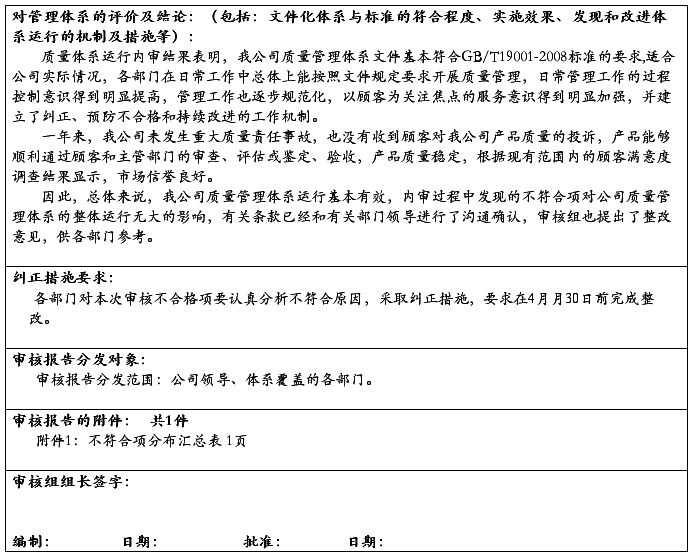
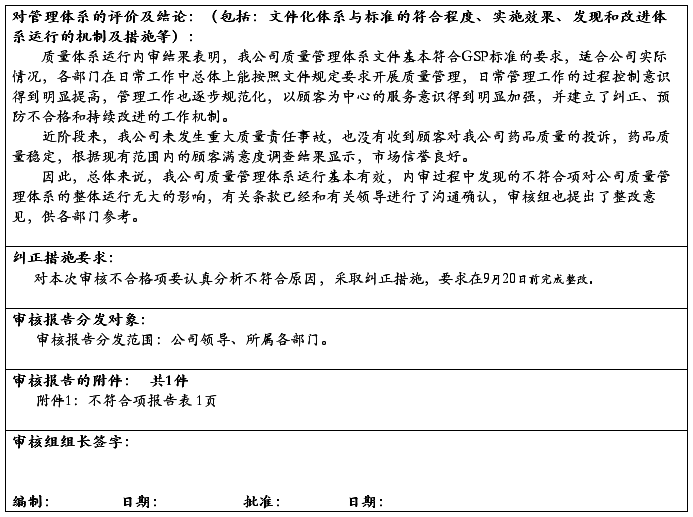
20##年4月20日,我们下发了“关于对20##年质量管理体系内审不符合项进行整改的通知”。对内审中发现的2项不符合项,做出了具体的整改工作安排和要求。各有关部门按照“20##年内审不符合项整改通知”的要求,都在规定的时间内针对所存在的不符合项,进行了原因分析,制订了纠正措施,并加以实施、纠正和改进。
4月20日至24日,综合管理部组织有关人员对不符合项的纠正整改措施进行了跟踪和效果验证。各项不符合项均进行了整改。
此次内审所发现的不符合项,没有严重不符合项,没有区域性不合格,分布分散。公司质量管理体系已具有防止不合格,满足顾客要求与法律法规的能力,已具有持续改进的机制。产品实物质量已处于受控状态。20##年公司产品整体质量,随着管理的提升和严格的质量把关,有了很大的改进和提高。
质 管 部
…… …… 余下全文