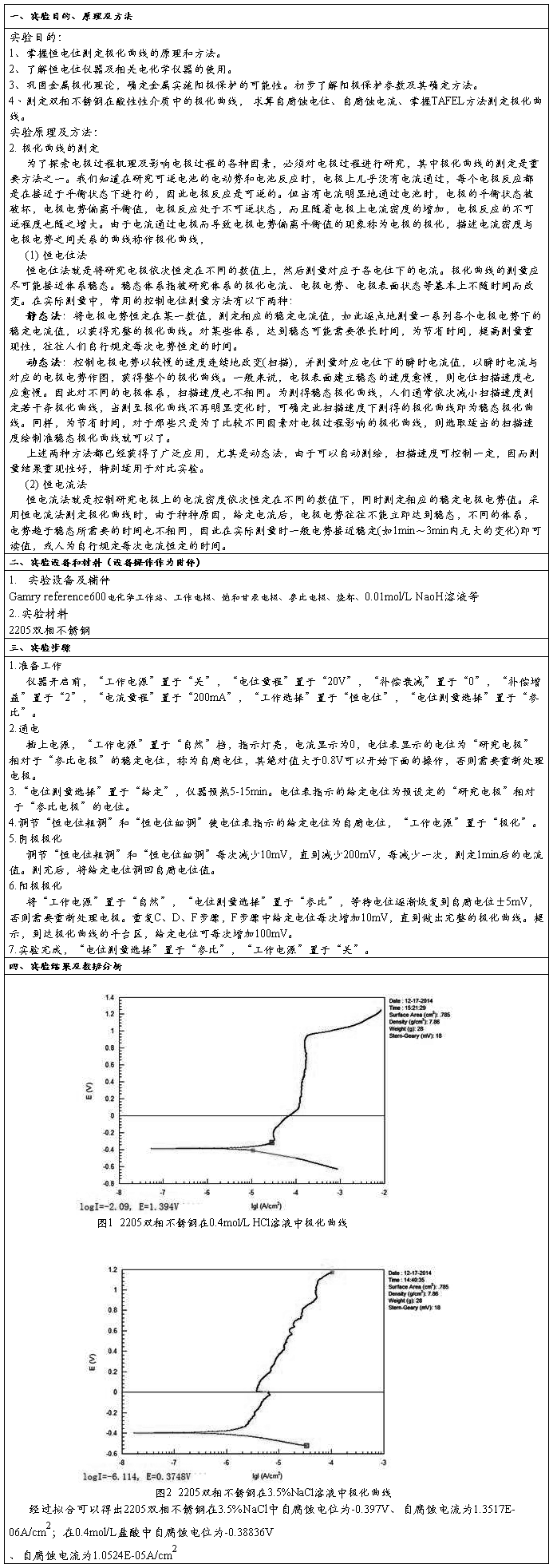
腐蚀金属电极稳态极化曲线测量和数据处理
一、实验目的:
1、掌握恒电位测定极化曲线的原理和方法
2、巩固金属极化理论,确定金属实施阳极保护的可能性。初步了解阳极保护参数及其确
定方法。
3、了解恒电位仪器及相关电化学仪器的使用。
4、测定铁在酸性介质中的极化曲线, 求算自腐蚀电位、自腐蚀电流、掌握线性扫描伏安法
和TAFEL方法测定极化曲线。
实验原理
铁在酸溶液中,将不断被溶解,同时产生H2,即:
Fe + 2H+ = Fe2+ + H2 (a)
Fe/HCl体系是-个二重电极,即在Fe/H+界面上同时进行两个电极反应: FeFe2+ + 2e (b)
2H+ + 2eH2 (c)
反应(b)、(c)称为共轭反应。正是由于反应(c)存在,反应(b)才能不断进行,
这就是铁在酸性介质中腐蚀的主要原因。
当电极不与外电路接通时,其净电流I总为零。在稳定状态下,铁溶解的阳极电
流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:
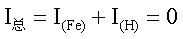
(1)
IFe的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势
称为Fe/H+体系的自腐蚀电势εcor。
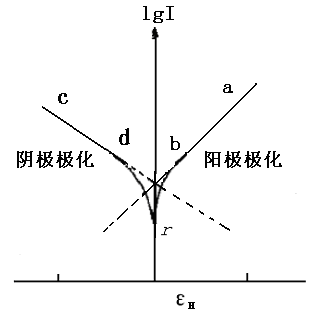
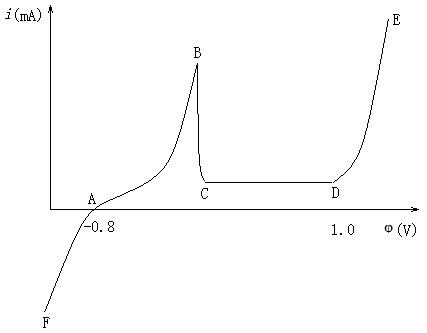
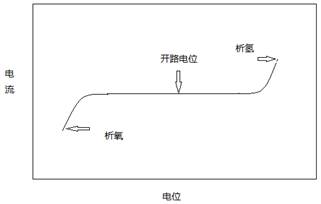
图12-1 Fe的极化曲线
图12-1是Fe在H+中的阳极极化和阴极极化曲线图。当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。此时,电化学过程以Fe的溶解为主要倾向。通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。。由于反应(c)是由迁越步骤所控制,所以符合塔菲尔(Tafel)半对数关系,即:
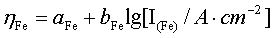
(2)
直线的斜率为bFe。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。同理,可获得阴极极化曲线rdc。由于H+在Fe电极上还原出H2的过程也是由迁越步骤所控制,故阴极极化曲线也符合塔菲尔关系,即:
…… …… 余下全文

 。根据法拉第定律,即在电解过程中,阴极上还原物质析出的量与所通过的电流强度和通电时间成正比,故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。因此求得金属腐蚀电流即代表了金属的腐蚀速度。金属处于自腐蚀状态时,外测电流为零。
。根据法拉第定律,即在电解过程中,阴极上还原物质析出的量与所通过的电流强度和通电时间成正比,故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。因此求得金属腐蚀电流即代表了金属的腐蚀速度。金属处于自腐蚀状态时,外测电流为零。