《可疑医疗器械不良事件报告表》
《医疗器械不良事件企业汇总报告表》填写说明
国家药品不良反应监测中心
一、 医疗器械不良事件定义:
获准上市的、合格的医疗器械在正常使用情况下,发生的或可能发生的任何与医疗器械预期使用效果无关的有害事件。
二、 报告范围:
需要医疗器械生产企业、经营企业、使用单位提供的可疑医疗器械不良事件报告是死亡和严重伤害报告。其中,严重伤害指①危及生命;②导致机体功能的永久性伤害或者机体结构的永久性损伤;③必须采取医疗措施才能避免上述永久性伤害或损伤。“永久性”是对身体结构或功能的不可逆的伤害,不包括小的伤害或损害。
对于一部分医疗器械未达到预期使用效果的也是安全性问题。这些事件可以是与使用医疗器械有关的,也可以是不能除外与医疗器械有关的事件。
三、 报告原则:
1、基本原则:造成患者、使用者或其他人员死亡、严重伤害的事件已经发生,
并且可能与所使用医疗器械有关,需要按可疑医疗器械不良事件报告。
2、濒临事件原则:有些事件当时并未造成人员伤害,但临床医务人员根据自己
的临床经验认为再次发生同类事件时会造成患者或医务人员死亡或严重伤害,则也需要报告。
3、不清楚即报告原则:在不清楚是否属于医疗器械不良事件时,按可疑医疗器械不良事件报告。
相关事件在以下情况必须报告:
⑴引起或造成死亡或严重伤害的几率较大;
⑵对医疗器械性能的影响性质严重,很可能引起或造成死亡或严重伤害; ⑶使器械不能发挥其必要的正常作用,并且影响医疗器械的治疗、检查或诊断作用,可能引起或造成死亡或严重伤害;
⑷医疗器械属于长期植入物或生命支持器械,因此对维持人类生命十分必要; ⑸医疗器械生产企业需要采取或被要求采取行动来减少产品对公众健康造成损害的风险;
⑹类似事件在过去实际已经引起或造成死亡或严重伤害。
四、 免除报告原则:
1、使用者在应用前发现医疗器械有缺陷
…… …… 余下全文
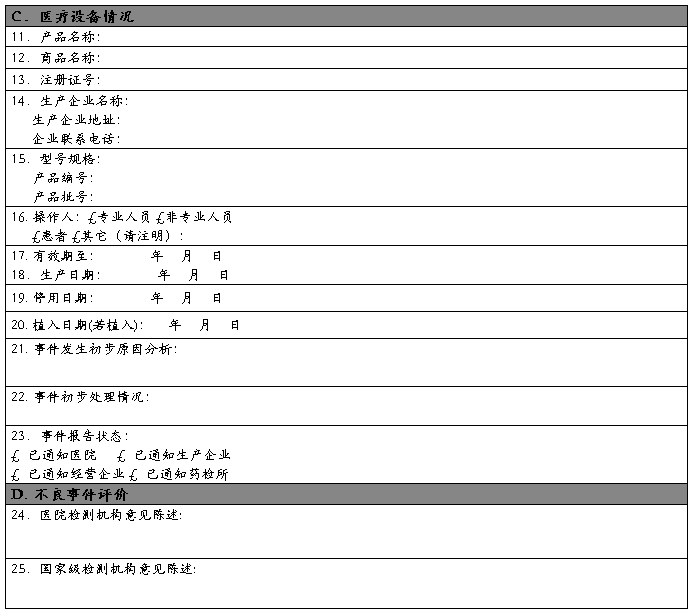
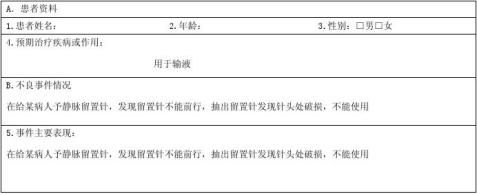
 医疗器械不良事件报告表
医疗器械不良事件报告表