酸碱中和滴定实验报告
时间:
组别: 第 组 指导教师: 组长: 组员:
一、实验目的:用已知浓度溶液(标准溶液)【本实验盐酸为标准溶液】测定未知溶液(待测
溶液) 浓度【本实验氢氧化钠为待测溶液】
二、实验原理:c(标)×V(标) = c(待)×V(待)【假设反应计量数之比为1:1】
三、实验仪器和药品
酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹、0.1000mol/L盐酸(标准液)、未知浓度的NaOH溶液(待测液)、酚酞(变色范围8~10)、甲基橙(3.1~4.4)
四、实验步骤
(一)滴定前的准备阶段
1、检漏:检查滴定管是否漏水
2、洗涤:先用蒸馏水洗涤滴定管,再用待装液润洗2~3次
3、量取:用碱式滴定管量出一定体积的未知浓度的NaOH溶液,注入锥形瓶中,并往
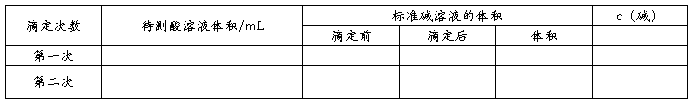
锥形瓶中滴加几滴酚酞,现象为 。用酸式滴定管量取标准液盐酸,使液面恰好在0刻度或0刻度以下某准确刻度,记录读数V1,读至小数点后第二位。
…… …… 余下全文