
缓冲溶液的配制和PH的测定
区县____________学号____________姓名___________
成绩_________

实验内容:
1.HAc-NaAc缓冲溶液的配制
注意:百里酚蓝指示剂的变色范围如下:

在试管中加入3mL0.1mol·L-1的HAc和3mL0.1mol·L-1的NaAc溶液就配制成了该缓冲溶液.加百里酚蓝指示剂5滴,显示___________色.
计算此缓冲溶液的pH
将配制的缓冲溶液为为3份.
(1)取一份,加入5滴0.1mol·L-1的盐酸,则颜色变化是_____________
_____________________________.再加入过量的0.1mol·L-1的盐酸,则颜色的变化是_________________________________.
(2)取一份, 加入5滴0.1mol·L-1的NaOH溶液,则颜色变化是________
_____________________________.再加入过量的0.1mol·L-1的NaOH溶液,则颜色的变化是_________________________________.
(3)取一份, 加入5滴水,则溶液的颜色变化是_________________.
…… …… 余下全文

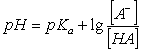 (1)
(1)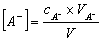
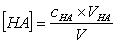
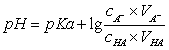 (2)
(2)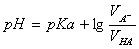 (3)
(3)
 7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。
7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。 CaIn-(酒红色) +H+
CaIn-(酒红色) +H+