实验 《混合碱的分析》实验报告
姓 名: 班 级: 柜 号: 日期:
一、实验目的:
二、原理:
三、实验步骤流程图:
四、实验结果与讨论:
1. mol·L-1HCl溶液浓度的标定
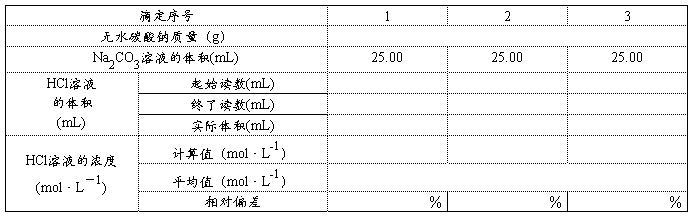
HCl溶液的浓度是 mol·L-1
2. 混合碱的分析

结论:混合碱溶液的组成是:NaOH mol·L-1;NaHCO3 mol·L-1;
…… …… 余下全文
实验 《混合碱的分析》实验报告
姓 名: 班 级: 柜 号: 日期:
一、实验目的:
二、原理:
三、实验步骤流程图:
四、实验结果与讨论:
1. mol·L-1HCl溶液浓度的标定

HCl溶液的浓度是 mol·L-1
2. 混合碱的分析

结论:混合碱溶液的组成是:NaOH mol·L-1;NaHCO3 mol·L-1;
…… …… 余下全文
实验九 混合碱中各组分含量的测定(微型滴定法) 一、 实验目的
1. 了解利用双指示剂法测定Na2CO3和NaHCO3混合物的原理和方法。 2. 学习用参比溶液确定终点的方法。 3. 进一步掌握微量滴定操作技术。 二、 实验原理
混合碱是NaCO3与NaOH或NaHCO3与Na2CO3的混合物。欲测定同一份试样中各组分的含量,可用HCl标准溶液滴定,根据滴定过程中pH值变化的情况,选用酚酞和甲基橙为指示剂,常称之为“双指示剂法”。
若混合碱是由Na2CO3和NaOH组成,第一等当点时,反应如下:
HCl+NaOH?NaCl+H2O
HCl+Na2CO3?NaHCO3+H2O
以酚酞为指示剂(变色pH范围为8.0~10.0),用HCl标准溶液滴定至
溶液由红色恰好变为无色。设此时所消耗的盐酸标准溶液的体积为V1(mL)。
第二等当点的反应为: HCl+NaHCO3?NaCl+CO2↑+H2O 以甲基橙为指示剂(变色pH范围为3.1~4.4),用HCl标准溶液滴至溶液由黄色变为橙色。消耗的盐酸标准溶液为V2(mL)。
当V1>V2时,试样为Na2CO3与NaOH的混合物,中和Na2CO3所消耗的HCl标准溶液为2V1(mL),中和NaOH时所消耗的HCl量应为(V1-V2)mL。据此,可求得混合碱中Na2CO3和NaOH的含量。
当V1<V2时,试样为Na2CO3与NaHCO3的混合物,此时中和Na2CO3消耗的HCl标准溶液的体积为2V1mL,中和NaHCO3消耗的HCl标准溶液的体积为(V2-V1)
mL。可求得混合碱中Na2CO3和NaHCO3的含量。
双指示剂法中,一般是先用酚酞,后用甲基橙指示剂。由于以酚酞作指示剂时从微红色到无色的变化不敏锐,因此也常选用甲酚红-百里酚蓝混合指示剂。甲酚红的变色范围为6.7(黄)~8.4(红),百里酚蓝的变色范围为8.0(黄)~9.6(蓝),混合后的变色点是8.3,酸色为黄色,碱色为紫色,混合指示剂变色敏锐。用盐酸标准溶液滴定试液由紫色变为粉红色,即为终点。
…… …… 余下全文
实验四 混合碱中NaOH Na2CO3含量的测定
总学时:4学时
一、实验目的
1. 掌握HCl标准溶液的配制和标定方法
2. 了解测定混合碱中NaOH Na2CO3含量的原理和方法
3. 掌握在同一份溶液中用双指示剂法测定混合碱中NaOH Na2CO3含量的测定
二、实验原理
碱液易吸收空气中的CO2形成Na2CO3,苛性碱实际上往往含有Na2CO3,故称为混合碱,在标定时,反应如下:
NaOH + Hcl ==== NaCl + H2O
Na2CO3 + Hcl ==== NaHCO3 + H2O
NaHCO3 + Hcl ==== NaCl + CO2 + H2O
可用酚酞及甲基橙来分别作指示剂,当酚酞变色时,NaOH全部被中和,而Na2CO3只被中和到一般,在此溶液汇总再加甲基橙指示剂,继续滴加到终点,则滴定完成
三、实验仪器及试剂
1. HCl标准溶液 酚酞
2. 0.2%乙醇溶液
3. 0.2%甲基橙指示剂
四、实验注意事项、特别提示
1. 在溶解混合碱试样时一定要用新煮沸的冷蒸馏水,使其充分的溶解,然后再移入容量瓶里,最后再用新煮沸的冷蒸馏水稀释至刻度
2. 如果待测试样为混合碱溶液,则直接用移液管准确吸取25ml试液三分,分别加入冷蒸馏水,按同法进行测定
3. 测定速度要慢,接近终点时每加一滴后摇匀,至颜色稳定后再加入第二滴,否则,因为颜色变化太慢,容易过量
…… …… 余下全文
实验四 混合碱中NaOH Na2CO3含量的测定
总学时:4学时
一、实验目的
1. 掌握HCl标准溶液的配制和标定方法
2. 了解测定混合碱中NaOH Na2CO3含量的原理和方法
3. 掌握在同一份溶液中用双指示剂法测定混合碱中NaOH Na2CO3含量的测定
二、实验原理
碱液易吸收空气中的CO2形成Na2CO3,苛性碱实际上往往含有Na2CO3,故称为混合碱,在标定时,反应如下:
NaOH + Hcl ==== NaCl + H2O
Na2CO3 + Hcl ==== NaHCO3 + H2O
NaHCO3 + Hcl ==== NaCl + CO2 + H2O
可用酚酞及甲基橙来分别作指示剂,当酚酞变色时,NaOH全部被中和,而Na2CO3只被中和到一般,在此溶液汇总再加甲基橙指示剂,继续滴加到终点,则滴定完成
三、实验仪器及试剂
1. HCl标准溶液 酚酞
2. 0.2%乙醇溶液
3. 0.2%甲基橙指示剂
四、实验注意事项、特别提示
1. 在溶解混合碱试样时一定要用新煮沸的冷蒸馏水,使其充分的溶解,然后再移入容量瓶里,最后再用新煮沸的冷蒸馏水稀释至刻度
2. 如果待测试样为混合碱溶液,则直接用移液管准确吸取25ml试液三分,分别加入冷蒸馏水,按同法进行测定
3. 测定速度要慢,接近终点时每加一滴后摇匀,至颜色稳定后再加入第二滴,否则,因为颜色变化太慢,容易过量
…… …… 余下全文
实验四 混合碱中NaOH Na2CO3含量的测定
总学时:4学时
一、实验目的
1. 掌握HCl标准溶液的配制和标定方法
2. 了解测定混合碱中NaOH Na2CO3含量的原理和方法
3. 掌握在同一份溶液中用双指示剂法测定混合碱中NaOH Na2CO3含量的测定
二、实验原理
碱液易吸收空气中的CO2形成Na2CO3,苛性碱实际上往往含有Na2CO3,故称为混合碱,在标定时,反应如下:
NaOH + Hcl ==== NaCl + H2O
Na2CO3 + Hcl ==== NaHCO3 + H2O
NaHCO3 + Hcl ==== NaCl + CO2 + H2O
可用酚酞及甲基橙来分别作指示剂,当酚酞变色时,NaOH全部被中和,而Na2CO3只被中和到一般,在此溶液汇总再加甲基橙指示剂,继续滴加到终点,则滴定完成
三、实验仪器及试剂
1. HCl标准溶液 酚酞
2. 0.2%乙醇溶液
3. 0.2%甲基橙指示剂
四、实验注意事项、特别提示
1. 在溶解混合碱试样时一定要用新煮沸的冷蒸馏水,使其充分的溶解,然后再移入容量瓶里,最后再用新煮沸的冷蒸馏水稀释至刻度
2. 如果待测试样为混合碱溶液,则直接用移液管准确吸取25ml试液三分,分别加入冷蒸馏水,按同法进行测定
3. 测定速度要慢,接近终点时每加一滴后摇匀,至颜色稳定后再加入第二滴,否则,因为颜色变化太慢,容易过量
…… …… 余下全文
实验四 混合碱中NaOH Na2CO3含量的测定
总学时:4学时
一、实验目的
1. 掌握HCl标准溶液的配制和标定方法
2. 了解测定混合碱中NaOH Na2CO3含量的原理和方法
3. 掌握在同一份溶液中用双指示剂法测定混合碱中NaOH Na2CO3含量的测定
二、实验原理
碱液易吸收空气中的CO2形成Na2CO3,苛性碱实际上往往含有Na2CO3,故称为混合碱,在标定时,反应如下:
NaOH + Hcl ==== NaCl + H2O
Na2CO3 + Hcl ==== NaHCO3 + H2O
NaHCO3 + Hcl ==== NaCl + CO2 + H2O
可用酚酞及甲基橙来分别作指示剂,当酚酞变色时,NaOH全部被中和,而Na2CO3只被中和到一般,在此溶液汇总再加甲基橙指示剂,继续滴加到终点,则滴定完成
三、实验仪器及试剂
1. HCl标准溶液 酚酞
2. 0.2%乙醇溶液
3. 0.2%甲基橙指示剂
四、实验注意事项、特别提示
1. 在溶解混合碱试样时一定要用新煮沸的冷蒸馏水,使其充分的溶解,然后再移入容量瓶里,最后再用新煮沸的冷蒸馏水稀释至刻度
2. 如果待测试样为混合碱溶液,则直接用移液管准确吸取25ml试液三分,分别加入冷蒸馏水,按同法进行测定
3. 测定速度要慢,接近终点时每加一滴后摇匀,至颜色稳定后再加入第二滴,否则,因为颜色变化太慢,容易过量
…… …… 余下全文
实 验 报 告
姓名: 班级: 同组人:
项目 碱度的测定 课程: 分析化学 学号:
一、实验目的
1、掌握酸碱滴定法测定碱度的原理和方法。
2、掌握碱度测定结果的计算。
3、熟练滴定操作及相关仪器的操作方法。
二、实验原理
水的碱度主要由碳酸盐、重碳酸盐、及氢氧化物组成,但在某些情况下,如水中存在
磷酸盐、硅酸盐、硼酸盐等也会产生一定的碱度。
碱度的测定是在水样中加入适当的指示剂,用酸标准溶液进行滴定,可分别测出水样
中各种碱度,其反应如下:
OH- + H+ = H2O CO32- + H+ = HCO3- HCO3-+ H+ = H2O + CO2
…… …… 余下全文
实验四 混合碱中NaOH Na2CO3含量的测定
总学时:4学时
一、实验目的
1. 掌握HCl标准溶液的配制和标定方法
2. 了解测定混合碱中NaOH Na2CO3含量的原理和方法
3. 掌握在同一份溶液中用双指示剂法测定混合碱中NaOH Na2CO3含量的测定
二、实验原理
碱液易吸收空气中的CO2形成Na2CO3,苛性碱实际上往往含有Na2CO3,故称为混合碱,在标定时,反应如下:
NaOH + Hcl ==== NaCl + H2O
Na2CO3 + Hcl ==== NaHCO3 + H2O
NaHCO3 + Hcl ==== NaCl + CO2 + H2O
可用酚酞及甲基橙来分别作指示剂,当酚酞变色时,NaOH全部被中和,而Na2CO3只被中和到一般,在此溶液汇总再加甲基橙指示剂,继续滴加到终点,则滴定完成
三、实验仪器及试剂
1. HCl标准溶液 酚酞
2. 0.2%乙醇溶液
3. 0.2%甲基橙指示剂
四、实验注意事项、特别提示
1. 在溶解混合碱试样时一定要用新煮沸的冷蒸馏水,使其充分的溶解,然后再移入容量瓶里,最后再用新煮沸的冷蒸馏水稀释至刻度
2. 如果待测试样为混合碱溶液,则直接用移液管准确吸取25ml试液三分,分别加入冷蒸馏水,按同法进行测定
3. 测定速度要慢,接近终点时每加一滴后摇匀,至颜色稳定后再加入第二滴,否则,因为颜色变化太慢,容易过量
…… …… 余下全文
