电池电动势的测定及其应用
摘要: 在本实验中,我们利用对消法测量电池电动势并计算相关热力学常数。首先我们通
过测量电池Ag(s),AgCl(s) | KCl(m1) || AgNO3(m2) | Ag(s) 的电动势,得到AgCl的溶度积Ksp,AgCl ;然后测量不同温度下Ag(s),AgCl(s) | KCl(m1) || AgNO3(m2) | Ag(s) 的电动势,作E-T图拟合进而求该反应的热力学常数ΔrGm ,ΔrSm ,ΔrHm 。
关键词: 对消法 可逆电池 电动势
The Measurement and the Application of the Battery
Electromotive Force
Abstract: In this experiment, we measure the electromotive force of cells (Using
compensation method) and apply these results to calculate some related hermodynamic constants.Firsr,we determine EMF of cell Ag(s),AgCl(s) | KCl(m1) || AgNO3(m2) | Ag(s) to get Ksp,AgCl ;Then we determine EMF of cell Ag(s),AgCl(s) | KCl(m1) || AgNO3(m2) | Ag(s) in different temperature to get ΔrGm ,ΔrSm andΔrHm .
Key words: Compensation method, Reversible cell, Electromotive force (EMF),
第 1 页 共 7 页 物理化学实验NO.8 PB07007303 王璐
…… …… 余下全文


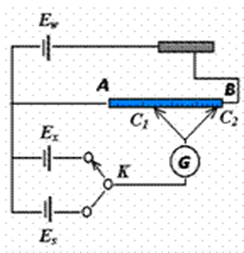

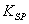 )的方法;
)的方法;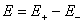
 、
、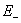 分别表示正、负电极的电位。当温度、压力恒定时,电池的电动势E(或电极电位
分别表示正、负电极的电位。当温度、压力恒定时,电池的电动势E(或电极电位 (16-1)
(16-1)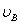 为参加电极反应的物质B的化学计量数,产物
为参加电极反应的物质B的化学计量数,产物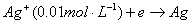
 (16-2)
(16-2)
 -RT/ZF·ln(α
还原/α
氧化)
-RT/ZF·ln(α
还原/α
氧化)

 1/2Hg2Cl2 + e-
1/2Hg2Cl2 + e- 
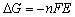 (9-1)
(9-1)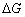 是电池反应的吉布斯自由能增量;n为电极反应中得失电子的数目;F为法拉第常数(其数值为96500
是电池反应的吉布斯自由能增量;n为电极反应中得失电子的数目;F为法拉第常数(其数值为96500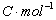 );E为电池的电动势。所以测出该电池的电动势E后,进而又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件:
);E为电池的电动势。所以测出该电池的电动势E后,进而又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件: