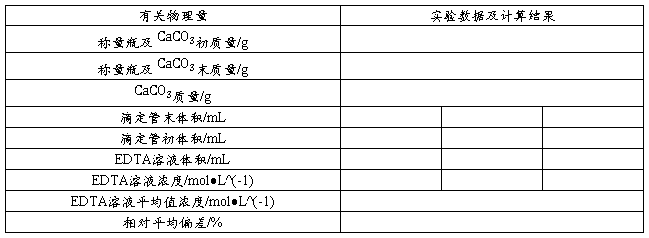
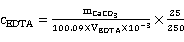EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定
一、实验目的
(1)、掌握EDTA标准溶液的配制与标定方法。
(2)、掌握铬黑T指示剂的应用条件和终点颜色变化。
二、实验原理
EDTA(Na2H2Y)标准溶液可用直接法配制,也可以先配制粗略浓度,再用金属Zn、ZnO、CaCO3或MgSO4· 7H2O等标准物质来标定。当用金属锌标定时,用铬黑T(H3In)做指示剂,在pH=10的款冲溶液中进行,滴定到溶液呈蓝色时为止。滴定反应式:
指示剂反应 Hln2- + Zn2+ = Znln- + H+
滴定反应 H2Y2- + Zn2+ = ZnY2- + 2H+
终点反应 Znln- + H2Y2- ↔ ZnY2- + Hln2- + H+
二、实验注意事项
(1)、称取EDTA和金属时,保留四位有效数;
(2)、控制好滴定速度;
(3)、加热锌溶解时,用表面皿盖住以免蒸发掉。
三、主要仪器与药品
仪器:酸式滴定管、25ml移液管、250ml容量瓶、250ml锥形瓶、250ml烧杯、表面皿。
药品:EDTA二钠盐、金属锌、1:1的氨水、1:1的HCl 、铬黑T指示剂、氨水—NH4Cl缓冲液(PH=10)
四、实验过程及原始数据记录
(1)、称取分析纯EDTA二钠盐1.9g左右,配制成500ml溶液。
(2)、称取0.15~0.2g金属Zn,加入1:1 HCl 5ml,盖好表面皿,使锌完全溶解,用水冲洗表面皿及烧杯内壁,然后将溶液移入250ml容量瓶中,再加水至刻度摇均,用25ml移液管吸此溶液置于250ml锥形瓶中,滴加1:1 氨水至开始出现Zn(OH)2白色沉淀,再加PH=10的缓冲溶液10ml ,加水稀释至100ml ,加入少许(约0.1g)铬黑T指示剂,用待标定的EDTA溶液滴定至溶液由酒红色变为纯蓝色,即为滴定终点。
…… …… 余下全文

 7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。
7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。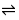 CaIn-(酒红色) +H+
CaIn-(酒红色) +H+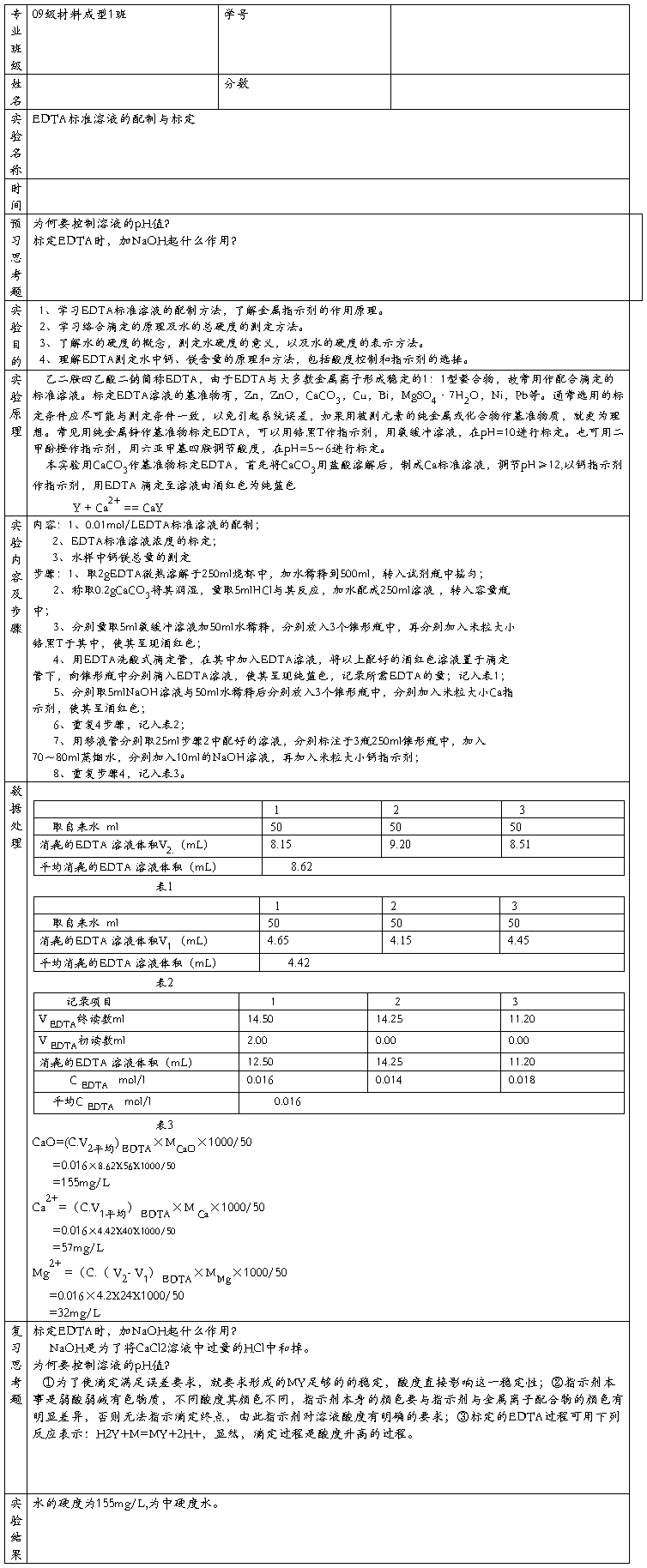

 实验5:EDTA溶液的配制和标定与水的硬度分析
实验5:EDTA溶液的配制和标定与水的硬度分析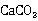 标定EDTA标准溶液;
标定EDTA标准溶液;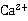 时,最适合于标定其浓度的基准物质是
时,最适合于标定其浓度的基准物质是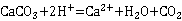
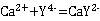
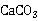 ,钙指示剂,1:1HCl溶液,20%NaOH
,钙指示剂,1:1HCl溶液,20%NaOH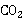 ,冷却后转移至250ml容量瓶,定容;
,冷却后转移至250ml容量瓶,定容;