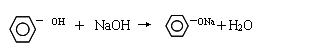高二化学期中考试工作总结
一、试题分析:
高二化学考试内容为选修四第一章、第二章内容,主要考查了化学反应与能量变化、热化学方程式的书写、盖斯定律的应用、化学反应速率的计算、影响化学反应速率的因素、化学平衡的判断影响因素及相关计算,中和热的测定实验等。
二、考试情况 :
考试题中选择题侧重基础知识、基本技能,符合教学实际,测试了学生的基础知识;非选择题侧重化学学科能力的考查;能力要求适当偏难。 考试情况来看,对于这次的试卷,总体感觉对于知识点的把握比较好,每道题的题型都很具有代表性题目,但组成一套试题相应的难度较大,同时题目对于我们的学生来说,还是有些过于灵活。我们的学生能力普遍不强,不会全面的分析问题,再加上基础知识掌握不牢,很难在脑中建立一个逻辑性比较强的知识网络,特别是一些综合性的题目,由于学生思维能力的欠缺,导致很多学生中等难度的题目分数拿不全,而难题就很难拿到分。这次考试全校及格人数30人(一班6人,二班1人,三班22人),85分以上2人。
三、教与学中存在的问题:1、教学中的问题主要表现在: ①学生对知识的理解没有系统性,而是片面的、狭隘的、零散和独立地。 ②本阶段的知识点又是整个高二阶段的难点和重点,学生来不及消化。 ③学生的课后查漏补缺没有跟上,以致出现了低分学生。
三、今后教学采取的措施:
1、回归课本,着眼双基,挖掘隐形关系,降 低 知 识 难 度 ,提 高 能 力要 求 ;因此,教学中必须切实注意这一环节的教习,讲究方法,注重实效,
努力把每一个概念及理论真正让学生弄清楚,做到因人施教,因材施教。
2、 经常联想,善于总结,把握知识网络,使学生考试得分、学会仅是一方面,还应善于归纳总结、经常联想,今后要多帮助学生建构一个系统的知识网络。
3、把握重点,消除盲点,切实做好纠错:重点其实就是选修4必考的重要知识点、盲点;就是要走出“越基础的东西越易出差错”的怪圈,除了思想上要予以高度重视外,还要对作业、考试中出现的差错,及时反思,及时纠正;对“事故易发地带”有意识地加以强化训练是一条有效的途径。每一次练习或考试后,要对差错做出详尽的分析,找出错误根源,到底是概念不清原理不明造成的知识性的障碍失分,还是粗心大意盲目审题出现的症结?对出现的差错要作记载,每隔一段时间都要进行一次分析总结,看看哪些毛病已“痊愈”,哪些“顽症”尚未根除,哪些是新犯的“毛病”,从而不断消除化学学习中的疑点、盲点;然后因人而异的采取强化的纠错方式加以解决。
…… …… 余下全文