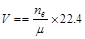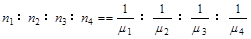第一章
1、工作电极基本要求:电极本身发生反应不会影响所研究的化学反应且能在较宽的电位内进行测定;电极不与溶液的任何组分反应;电极面积不宜太大,表面均匀光滑且易于进行表面净化。
2、辅助电极基本要求:与工作电极相比辅助电极应有大的表面积使得极化作用于工作电极;辅助电极的电阻要小,且不容易极化.对形状和位置也有要求.
3、参比电极的性能:为可逆电极,电极电势符合Nernst方程,参比电极反应有较大的交换电流密度,流过微小电流时电极电势能迅速复原,具有良好的电势稳定性、重现性等。
4、双电层理论的BDM模型
内层:最靠近电极的一层(紧密层),由溶剂分子+特性吸附物质组成。
第一层:水分子层:φM
第二层:水化离子剩余电荷层;
IHP(内Helmholtz层):特性吸附离子的电中心位置(距离x1处);
OHP(外Helmholtz层):最接近电极的溶剂化离子(非特性吸附离子)的中心位置(距离x2处);
分散层:OHP层与溶液本体之间。
5、电极反应种类
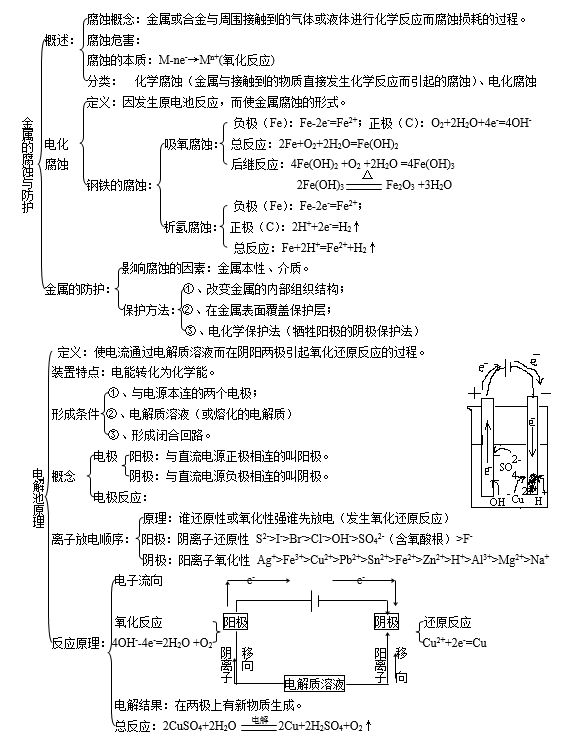
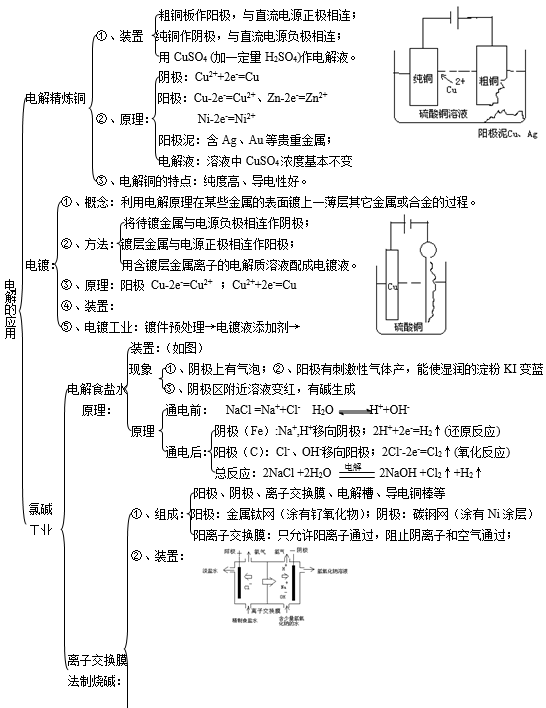
⑴ 简单电子迁移反应:电极/溶液界面的溶液一侧的氧化、还原物种借助于电极得到或失去电子,生成还原或氧化态的物种而溶解于溶液中,电极在经历氧化-还原后其物理化学性质、表面状态等不发生改变。
如Pt电极上: Fe 3+ + e → Fe 2+
⑵ 金属沉积反应:溶液中的金属离子从电极上得到电子还原为金属,附着于电极表面,电极表面状态与沉积前相比发生了变化。
…… …… 余下全文

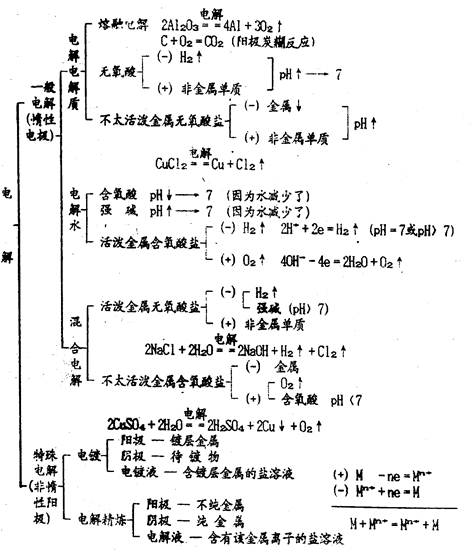
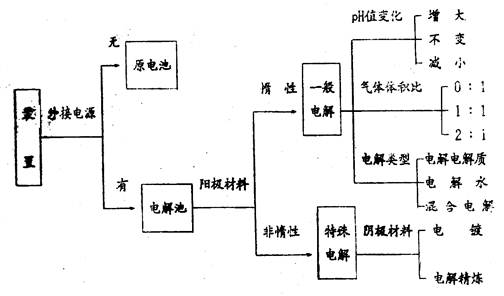
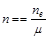 ,式中,ne表示电路上流过的电子的物质的量,m表示化合价总价数。
,式中,ne表示电路上流过的电子的物质的量,m表示化合价总价数。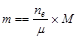 ;
;