第三章 水溶液中的离子平衡
一、弱电解质的电离
1、定义:电解质: 在水溶液中或熔化状态下能导电的化合物,叫电解质 。
非电解质 : 在水溶液中或熔化状态下都不能导电的化合物 。
强电解质 : 在水溶液里全部电离成离子的电解质 。
弱电解质: 在水溶液里只有一部分分子电离成离子的电解质 。
2、电解质与非电解质本质区别:
电解质——离子化合物或共价化合物 非电解质——共价化合物
注意:①电解质、非电解质都是化合物 ②SO2、NH3、CO2等属于非电解质 ③强电解质不等于易溶于水的化合物(如BaSO4不溶于水,但溶于水的BaSO4全部电离,故BaSO4为强电解质)——电解质的强弱与导电性、溶解性无关。
3、电离平衡:在一定的条件下,当电解质分子电离成 离子的速率 和离子结合成 时,电离过程就达到了 平衡状态 ,这叫电离平衡。
4、影响电离平衡的因素:
A、温度:电离一般吸热,升温有利于电离。
B、浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。
C、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会 减弱 电离。
D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。
9、电离方程式的书写:用可逆符号 弱酸的电离要分布写(第一步为主)
10、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。 )
表示方法:AB A++B- Ki=[ A+][ B-]/[AB]
…… …… 余下全文



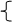 电解质——离子化合物或共价化合物
电解质——离子化合物或共价化合物 
 H+ + OH- 水的离子积:KW = [H+]·[OH-]
H+ + OH- 水的离子积:KW = [H+]·[OH-] 

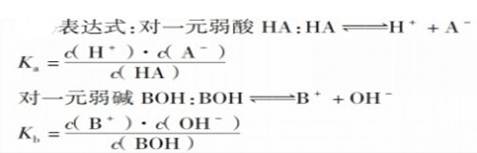 ①概念:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积跟溶液中未电离的分子浓度的比是一个常数。这个常数叫做电离平衡常数,简称电离常数,用K来表示。通常用Ka表示弱酸的电离常数,用 运遭表示Kb的电离常数。
①概念:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积跟溶液中未电离的分子浓度的比是一个常数。这个常数叫做电离平衡常数,简称电离常数,用K来表示。通常用Ka表示弱酸的电离常数,用 运遭表示Kb的电离常数。