第二单元:我们周围的空气
考点1.空气成分的发现。
二百多年前,法国化学家拉瓦锡用定量方法研究了空气的成分。空气由氧气和氮气组成,其中氧气约占空气总体积的1/5。
考点2.测定空气中氧气含量的实验
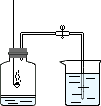 【实验原理及方法】利用过量的红磷在集有空气的集气瓶中燃烧,(使集气瓶中气体体积减小,压强减小),观察集气瓶中进水的多少,来测定空气中氧气的体积分数。4P+5O2
【实验原理及方法】利用过量的红磷在集有空气的集气瓶中燃烧,(使集气瓶中气体体积减小,压强减小),观察集气瓶中进水的多少,来测定空气中氧气的体积分数。4P+5O2 2P2O5
2P2O5
【实验装置】如右图所示。弹簧夹关闭。集气瓶内加入少量水,并做上记号。
【实验步骤】
① 连接装置,并检查装置的气密性。
② 点燃燃烧匙内的红磷,立即伸入集气瓶中,并塞紧塞子。
③ 待红磷熄灭并冷却后,打开弹簧夹。
【实验现象】① 红磷燃烧,产生大量白烟;② 放热;③ 冷却后打开弹簧夹,水沿着导管进入集气瓶中,进入集气瓶内水的体积约占集气瓶空气总体积的1/5。
【实验结论】① 红磷燃烧消耗空气中的氧气,生成五氧化二磷固体;② 空气中氧气的体积约占空气总体积的1/5。
【注意事项】实验成功的关键
1) 红磷必须过量。如果红磷的量不足,集气瓶内的氧气没有被完全消耗,测量结果会偏小。
2) 装置气密性要好。如果装置的气密性不好,集气瓶外的空气进入集气瓶,测量结果会偏小。
3) 导管中要注满水。否则当红磷燃烧并冷却后,进入的水会有一部分残留在试管中,导致测量结果偏小。
4) 冷却后再打开弹簧夹,否则测量结果偏小。
5) 如果弹簧夹未夹紧,或者塞塞子的动作太慢,测量结果会偏大。
…… …… 余下全文

 2P2O5
2P2O5
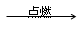 4、原理:表达式:磷(P) + 氧气(O2) 五氧化二磷(P2O5)
4、原理:表达式:磷(P) + 氧气(O2) 五氧化二磷(P2O5) 2P2O5
2P2O5 2P2O5
2P2O5
 2P2O5
2P2O5
 2P2O5
2P2O5


 ①氧气: 供呼吸 (如潜水、医疗急救)
①氧气: 供呼吸 (如潜水、医疗急救) 