一、有机物的概念
1、定义:含有碳元素的化合物为有机物(碳的氧化物、碳酸、碳酸盐、碳的金属化合物等除外)
2、特性:①种类多 ②大多难溶于水,易溶于有机溶剂 ③易分解,易燃烧 ④熔点低,难导电、大多是非电解质 ⑤反应慢,有副反应(故反应方程式中用“→”代替“=”)
二、烃—碳氢化合物:仅有碳和氢两种元素组成
1、甲烷,组成最简单的烃,物理性质:无色、无味的气体,极难溶于水,密度小于空气,俗名:沼气、坑气
2、分子结构:CH4:以碳原子为中心, 四个氢原子为顶点的正四面体(键角:109度28分)
3、化学性质:①氧化反应:CH4 + 2O2 → CO2 + 2H2O
甲烷与KMnO4不发生反应,所以不能使紫色KMnO4溶液褪色
②取代反应: CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 →CH2Cl2 + HCl
CH2Cl2 + Cl2 →CHCl3 + HCl
CHCl3 + Cl2 →CCl4 + HCl
(三氯甲烷又叫氯仿,四氯甲烷又叫四氯化碳,二氯甲烷只有一种结构,说明甲烷是正四面体结构)
4、同系物:结构相似,在分子组成上相差一个或若干个CH2原子团的物质(所有的烷烃都是同系物)
5、同分异构体:化合物具有相同的分子式,但具有不同结构式(结构不同导致性质不同)
6、烷烃的溶沸点比较:碳原子数不同时,碳原子数越多,溶沸点越高;碳原子数相同时,支链数越多熔沸点越低
三、乙烯
1、乙烯的制法:
工业制法:石油的裂解气(乙烯的产量是一个国家石油化工发展水平的标志之一)
2、物理性质:无色、稍有气味的气体,比空气略轻,难溶于水
3、结构:不饱和烃,分子中含碳碳双键,6个原子共平面,键角为120°
4、化学性质:
(1)氧化反应:C2H4 + 3O2 → 2CO2 + 2H2O (火焰明亮并伴有黑烟)
…… …… 余下全文

 1.甲烷与氯气混合光照
1.甲烷与氯气混合光照


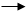
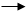 CH
4+Cl
2 CH
3Cl+HCl CH
3Cl+Cl
2 CH
2Cl
2+HCl
CH
4+Cl
2 CH
3Cl+HCl CH
3Cl+Cl
2 CH
2Cl
2+HCl
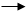
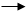 CH2Cl2+Cl2 CHCl3+HCl CHCl3+Cl2 CCl4+HCl
CH2Cl2+Cl2 CHCl3+HCl CHCl3+Cl2 CCl4+HCl 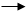 CH2 = CH2 + Br2 CH2BrCH2Br
CH2 = CH2 + Br2 CH2BrCH2Br 3.乙烯与水反应
3.乙烯与水反应
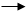 CH2 = CH2 + H2O CH3CH2OH
CH2 = CH2 + H2O CH3CH2OH 
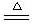 2Li2 O
2Li2 O 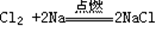 5、Na与Cl2反应(点燃):
5、Na与Cl2反应(点燃):  2Li2 O
2Li2 O 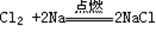 5、Na与Cl2反应(点燃): 6、用电子式表示氯化氢的形成过程:
5、Na与Cl2反应(点燃): 6、用电子式表示氯化氢的形成过程: