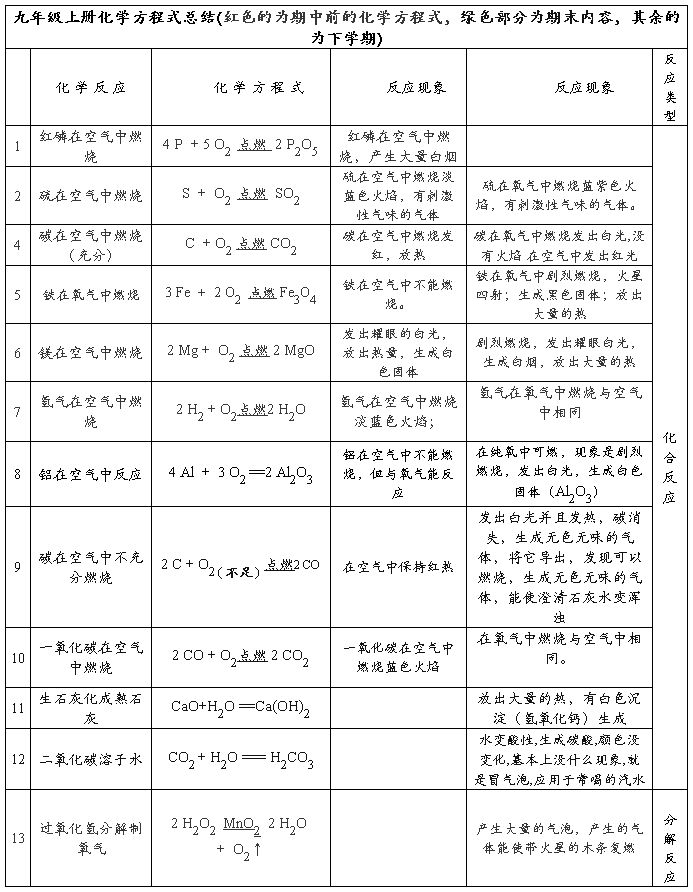
化学方程式汇总
一.化合反应:
点燃
*1、镁在空气中燃烧:2Mg + O2==2MgO
点燃
2、铁在氧气中燃烧:3Fe+2O2==Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 *3、铝在空气中燃烧:4Al+3O2 == 2Al2O3 银白金属变为白色固体 点燃
4、氢气在空气中燃烧:2H2 + O2== 2H2O 点燃
5、红磷在空气中燃烧:4P + 5O2 == 2P2O5 点燃
6、硫粉在空气中燃烧: S + O2 ==SO2
点燃
7、碳在氧气中充分燃烧:C + O2 == CO2 ....点燃
8、碳在氧气中不充分燃烧:2C + O2 == 2CO .....9、二氧化碳通过灼热碳层: C + CO2
高温
△
2CO
点燃
10、一氧化碳在氧气中燃烧:2CO + O2 ==2CO2
*11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3 *12、生石灰溶于水:CaO + H2O === Ca(OH)2 点燃
*13、钠在氯气中燃烧:2Na + Cl2 ==2NaCl
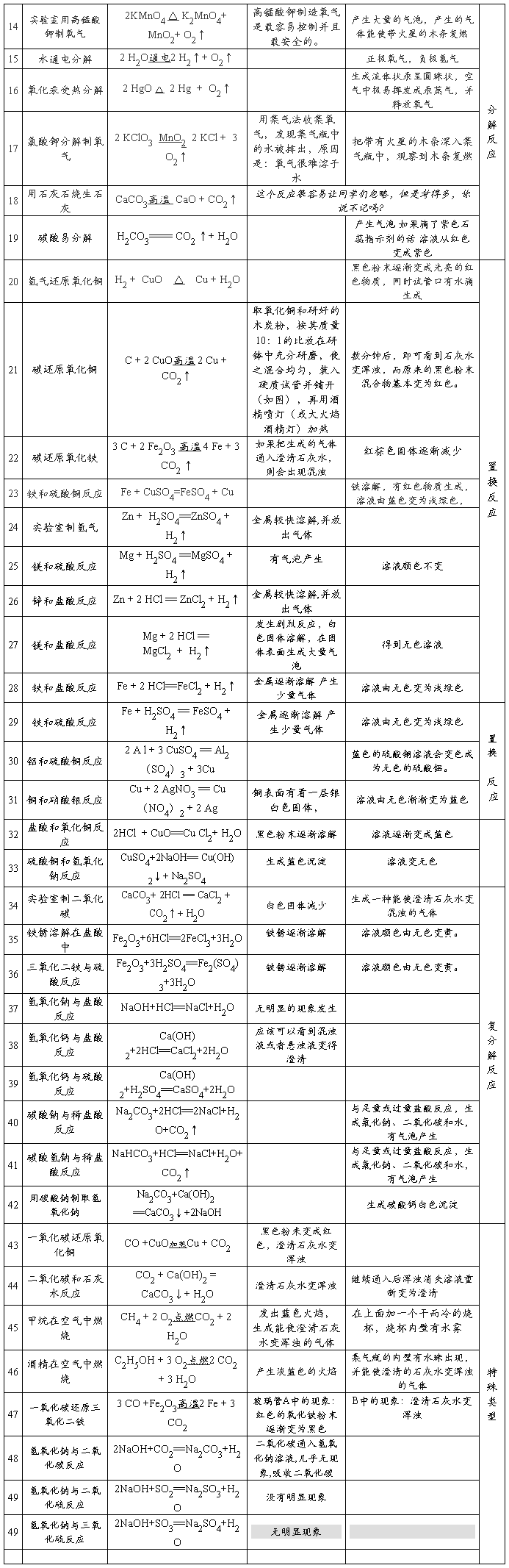
二.分解反应:
14、实验室用双氧水制氧气:2H2O2 ▲15、加热高锰酸钾:2KMnO4
MnO2
2H2O+ O2↑
△
==K2MnO4 + MnO2 + O2↑
通电
16、水在直流电的作用下分解:2H2O2H2↑+ O2↑
17、碳酸不稳定而分解:H2CO3 == H2O + CO2↑ *18、高温煅烧石灰石(二氧化碳工业制法):CaCO3
高温
CaO + CO2↑
三.置换反应
19、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
*20、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑
1
21、氢气还原氧化铜:H2 + CuO 22、木炭还原氧化铜:C+ 2CuO
…… …… 余下全文


 2MgO 2、铁燃烧:3Fe+2O2
2MgO 2、铁燃烧:3Fe+2O2 Fe3O4
Fe3O4 CO2 (充分燃烧) 2C+O2
CO2 (充分燃烧) 2C+O2 2CuO
2CuO 2CO
2CO  2KCl+3O2↑
2KCl+3O2↑