高中化学(人教版)必修二相关化学方程式汇总
第一章 物质结构 元素周期律
1、Li与O2反应(点燃): 4Li + O2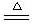 2Li2 O
2Li2 O
Na与O2反应(点燃): 2Na+O2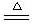 Na2O2
Na2O2
2、卤素单质F2 、Cl2 、Br2 、I2与氢气反应:
F2 + H2 === 2HF Cl2 + H2=== 2HCl
Br2 + H2=== 2Br I2 + H2=== 2HI
3、卤素单质间的置换反应:
(1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应:
① Cl2+2NaBr===Br2+2NaCl
② Cl2+2NaI===I2+2NaCl
(2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr
4、Mg与H2O反应:Mg+2H2O === Mg(OH)2+H2↑
Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑
Mg与HCl反应: Mg+2 HCl === MgCl2+ H2↑
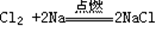 5、Na与Cl2反应(点燃):
5、Na与Cl2反应(点燃):
…… …… 余下全文

 2Li2O
2Li2O 2HBr、I2 +H2
2HBr、I2 +H2 2HI
2HI  CO2+2H2O;
CO2+2H2O;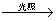 CH3Cl+HCl
CH3Cl+HCl 