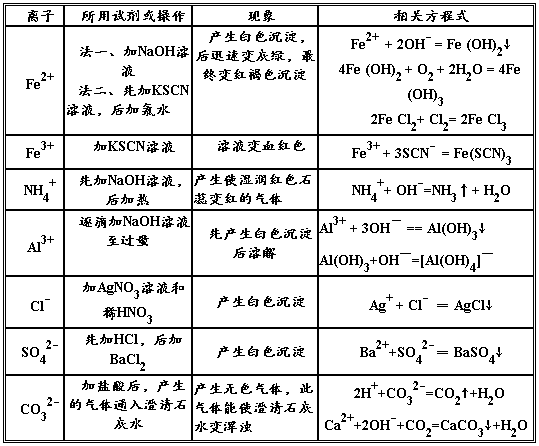
必修一化学方程式及离子方程式小结
1、 硫酸根离子的检验:
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl SO42- + Ba2+ == BaSO4↓
2、 碳酸根离子的检验:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl CO32- + Ca2+== CaCO3↓
3、 碳酸钠与盐酸反应:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+== CO2↑+ H2O
4、木炭还原氧化铜: 2CuO + C  2Cu + CO2↑
2Cu + CO2↑
5、钠与非金属单质反应:
4Na+O2=2Na2O
2Na+O2 Na2O2
Na2O2
Cl2 +2Na 2NaCl
2NaCl
6、钠与水反应:2Na+2H2O=2NaOH+H2↑ 2Na + 2H2O == 2Na+ + 2OH- + H2↑
7、氧化钠的主要化学性质:2Na2O+O2 2Na2O2
2Na2O2
Na2O+H2O=2NaOH Na2O+SO3=Na2SO4
Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2O
8、过氧化钠的主要反应:
2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2
…… …… 余下全文

 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑  Na2O2
Na2O2  2Na+Cl2↑
2Na+Cl2↑ Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
 2Cu + CO2↑
2Cu + CO2↑ 2MgO + C
2MgO + C Na2O2
Na2O2 2Na2O2
2Na2O2