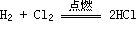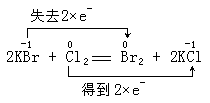化学必修一知识体系归纳
第一部分:基本理论基本概念部分
1.物质的量及其应用
(1)物质的量
(1)符号:n. 单位:摩尔(mol)。
(2)基准:以0.012kg 12 6c中所含的碳原子数为基准,即阿伏加德罗常数。
(2)阿伏加德罗常数
(1)符号:NA。单位:mol-1.
(2)阿伏加德罗在应用中用6.02×1023 mol-1作为它的最大近似值用于计算。
(3)物质的量(n)、粒子数(N)和阿伏加德罗常数(NA)的关系
粒子数比等于物质的量比
(4)摩尔质量
(1)符号:M;单位:g·mol-1(常用).
(2)计算公式:
(5)阿伏加德罗定律和气体摩尔体积
(1)决定物质体积的主要内因:物质微粒本身大小、微粒的间距和微粒的数目。
(2)决定气体体积的主要内因:气体分子数和气体分子间距。
(3)在同温同压下,任何气体分子的间距都相等。
(4)阿伏加德罗定律:同温同压下,等物质的量的任何气体体积相等。
①对定律的理解:条件的三个相同推出结论的一个相同。即:

②定律的推论:
a 同温同压,气体的物质的量比等于体积比等于分子数比;
b 同温同压,气体的密度比等于其摩尔质量比;
c 同温同压,同体积,气体的密度比等于摩尔质量比等于质量比。
(5)气体摩尔体积:
①符号:Vm,单位:L/mol.②标况下,1mol任何气体的体积都约为22.4L.即标况下,Vm=22.4 L/mol.
③计算公式:标况下,n=V/(22.4 L/mol).④气体摩尔质量的几种计算方法:a. M=m/n; b.标况下,M=22.4×d (d是气体的密度,单位是g/L)c.相对密度D=M1/M2 (M1是未知气体的摩尔质量,M2是已知气体的摩尔质量)
(6)物质的量浓度
(1)定义:单位体积溶液中所含溶质的物质的量来表示的浓度.符号:CB,单位:mol/L.计算公式: C=n/v.
…… …… 余下全文

 质子(Z个)
质子(Z个)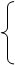 原子核 注意:
原子核 注意: 1.原子数
A X 原子序数=核电荷数=质子数=原子的核外电子
1.原子数
A X 原子序数=核电荷数=质子数=原子的核外电子

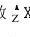
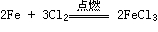 (1.)Cl2与金属反应(一般将金属氧化成高价态)
(1.)Cl2与金属反应(一般将金属氧化成高价态)