高中化学常见物质物理性质总结
1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。其它物质的颜色见会考手册的颜色表。
2、有刺激性气味的气体:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、Br2(g);有臭鸡蛋气味的气体:H2S。
3、熔沸点、状态:
① 同族金属从上到下熔沸点减小,同族非金属从上到下熔沸点增大。
② 同族非金属元素的氢化物熔沸点从上到下增大,含氢键的NH3、H2O、HF反常。
③ 常温下呈气态的有机物:碳原子数小于等于4的烃、一氯甲烷、甲醛。
④ 熔沸点比较规律:原子晶体>离子晶体>分子晶体,金属晶体不一定。
⑤ 原子晶体熔化只破坏共价键,离子晶体熔化只破坏离子键,分子晶体熔化只破坏分子间作用力。
⑥ 常温下呈液态的单质有Br2、Hg;呈气态的单质有H2、O2、O3、N2、F2、Cl2;常温呈液态的无机化合物主要有H2O、H2O2、硫酸、硝酸。
⑦ 同类有机物一般碳原子数越大,熔沸点越高,支链越多,
熔沸点越低。
同分异构体之间:正>异>新,邻>间>对。
⑧ 比较熔沸点注意常温下状态,固态>液态>气态。如:白磷>二硫化碳>干冰。
⑨ 易升华的物质:碘的单质、干冰,还有红磷也能升华(隔绝空气情况下),但冷却后变成白磷,氯化铝也可;三氯化铁在100度左右即可升华。
⑩ 易液化的气体:NH3、Cl2 ,NH3可用作致冷剂。
4、溶解性
① 常见气体溶解性由大到小:NH3、HCl、SO2、H2S、Cl2、CO2。极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。极易溶于水的气体尾气吸收时要用防倒吸装置。
…… …… 余下全文



 ),生成相应的盐并放出二氧化碳。
),生成相应的盐并放出二氧化碳。
 ;
;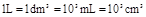

 单位:
单位: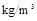 、
、


