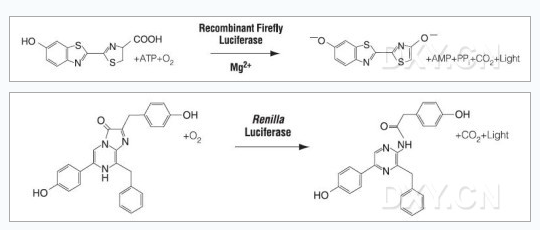
亦称发光酶。是催化生物发光的酶系的总称。它是光物质的冷水抽提物在氧中发光时,底物虫荧光素被消耗以后残余的对热不稳定的高分子成分。现在对萤虫相海萤以及发光细菌的虫荧光素酶结晶物的研究得最多。它们属于加氧酶
(oxygenase),不含金属和辅酶。对于发光,有的酶必须以ATP等作为辅助因子,有的则不需要。其发光机制等已了解到可因种的不同而有很大的差异,虫萤光素酶具有高度的特异性,一般仅作用于来自近缘种的虫荧光素。当然,萤虫、海萤的酶是不能互相代替引起发光的。海萤的虫荧光素酶在干燥状态下相当稳定,可以保存
双荧光素酶报告基因测试∶ 结合萤火虫和海洋腔肠荧光素酶先进的共报告基因测试技术
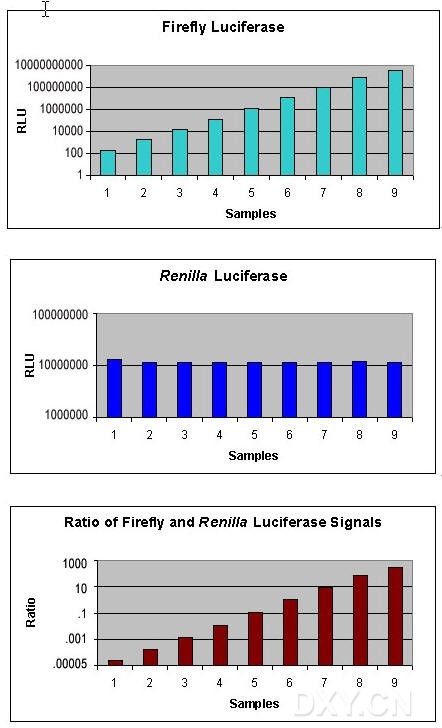
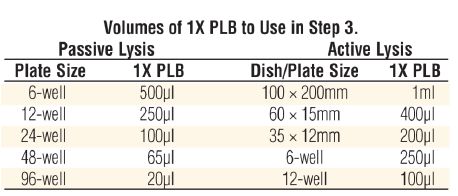
在用萤火虫荧光素酶定量基因表达时 ,通常采用第二个报告基因来减少实验的变化因素。但传统的共报告基因(比如CAT,β-Gal,GUS)不够便利,因为各自的测试化学,处理要求,检测特点存在差异。Promega提供一种先进的双报告基因技术,结合了萤火虫荧光素酶测试和海洋腔肠荧光素酶测试。双荧光素酶报告基因测试系统,结合pRL载体系统,表达第二个报告基因海洋腔肠荧光素酶,在单管中进行双荧光素酶报告基因测试,快速,灵敏,简便。系统还提供PLB裂解液,用来裂解在多孔板中培养的哺乳细胞,不需操作单个样品。对于正在使用萤火虫荧光素酶报告基因载体的研究人员。双荧光素酶报告基因测试系统将使他们立即体会到该系统的便利。
介 绍
双报告基因用于实验系统中作相关的或成比例的检测, 通常一个报告基因作为内对照, 使另一个报告基因的检测均一化。检测基因表达时双报告基因通常用来瞬时转染培养细胞,带有实验报告基因的载体共转染带有不同的报告基因作为对照的第二个载体。通常实验报告基因偶联到调控的启动子, 研究调控基因的结构和生理基础。报告基因表达活力的相对改变与偶联调控启动子转录活力的改变相关,偶联到组成型启动子的第二个报告基因,提供转录活力的内对照, 使测试不被实验条件变化所干扰。
…… …… 余下全文

 基因表达
基因表达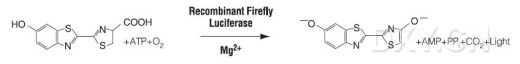

 报告基因
报告基因