实验二 燃烧热的测定
一、目的要求
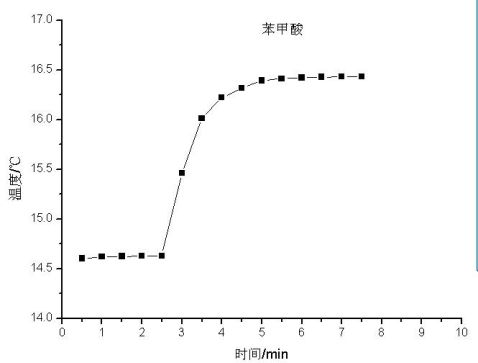
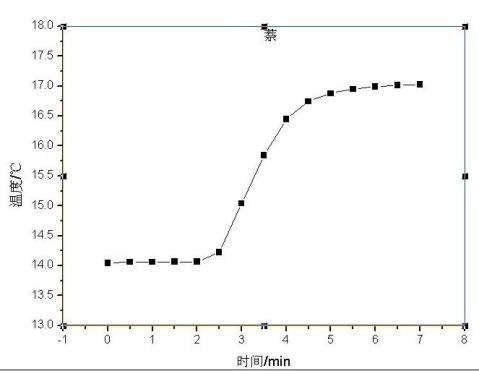
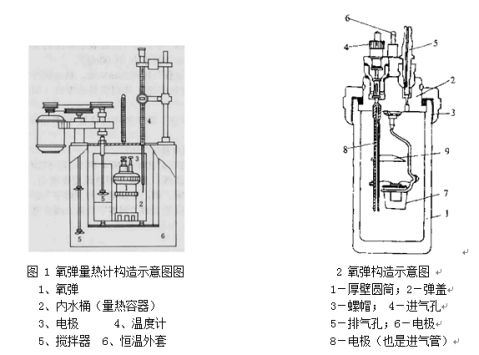
1.用氧弹量热计测定萘的燃烧热。
2.了解氧弹量热计的原理、构造及使用方法。
二、实验原理
1摩尔物质完全氧化时的反应热称为燃烧热。所谓完全氧化是指C变为CO2(气),H变为H2O(液),S变为SO2(气),N变为N2(气),如银等金属都变成为游离状态。
例如:在25℃、1.01325×105Pa下苯甲酸的燃烧热为-3226.9kJ/mol,反应方程式为:
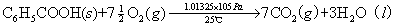
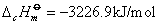
对于有机化合物,通常利用燃烧热的基本数据求算反应热。燃烧热可在恒容或恒压条件下测定,由热力学第一定律可知:在不做非膨胀功的情况下,恒容燃烧热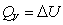 ,恒压燃烧热
,恒压燃烧热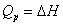 。在体积恒定的氧弹式量热计中测得的燃烧热为QV,而通常从手册上查得的数据为Qp,这两者可按下列公式进行换算
。在体积恒定的氧弹式量热计中测得的燃烧热为QV,而通常从手册上查得的数据为Qp,这两者可按下列公式进行换算
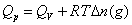 (2-1)
(2-1)
式中,Δn(g)——反应前后生成物和反应物中气体的物质的量之差;
R——气体常数;
T——反应温度,用绝对温度表示。
通常测定物质的燃烧热,是用氧弹量热计,测量的基本原理是能量守恒定律。一定量被测物质样品在氧弹中完全燃烧时,所释放的热量使氧弹本身及其周围的介质和量热计有关附件的温度升高,测量介质在燃烧前后温度的变化值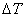 ,就能计算出该样品的燃烧热。
,就能计算出该样品的燃烧热。
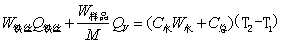 (2-2)
(2-2)
式中,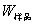 ,M——分别为样品的质量和摩尔质量;
,M——分别为样品的质量和摩尔质量;
QV——为样品的恒容燃烧热;
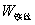 ,
,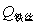 ——引燃用的铁丝的质量和单位质量的燃烧热(
——引燃用的铁丝的质量和单位质量的燃烧热( );
);
…… …… 余下全文

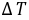 ,就能计算出该样品的燃烧热。
,就能计算出该样品的燃烧热。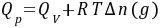 (1)
(1)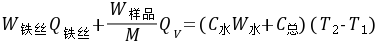 (2)
(2)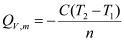
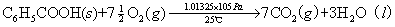
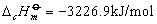
 ,恒压燃烧热
,恒压燃烧热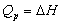 。在体积恒定的氧弹式量热计中测得的燃烧热为QV,而通常从手册上查得的数据为Qp,这两者可按下列公式进行换算
。在体积恒定的氧弹式量热计中测得的燃烧热为QV,而通常从手册上查得的数据为Qp,这两者可按下列公式进行换算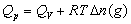 (2-1)
(2-1)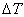 ,就能计算出该样品的燃烧热。
,就能计算出该样品的燃烧热。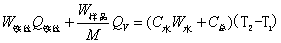 (2-2)
(2-2)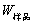 ,M——分别为样品的质量和摩尔质量;QV——为样品的恒容燃烧热;
,M——分别为样品的质量和摩尔质量;QV——为样品的恒容燃烧热;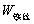 ,
,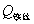 ——引燃用的铁丝的质量和单位质量的燃烧热(
——引燃用的铁丝的质量和单位质量的燃烧热(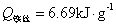 );
);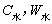 ——分别为水的比热容和水的质量;
——分别为水的比热容和水的质量;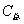 ——是量热计的总热容(氧弹、水桶每升高1K,所需的总热量);
——是量热计的总热容(氧弹、水桶每升高1K,所需的总热量);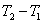 ——即
——即
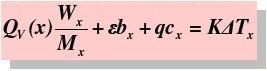 待测物质
待测物质
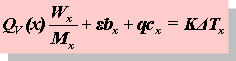 待测物质
待测物质