
篇二 :蛋白酶的盐析沉淀实验报告
蛋白酶的盐析沉淀实验报告
班级:生工1005 学号:0203100520 姓名:朱同辉
实验目的:
1.掌握使蛋白质胶体溶液保持稳定的因素;
2.了解蛋白质沉淀的几种方法及其意义;
3.掌握测定蛋白酶活力的原理和方法;
4.学习酶活力的计算方法。
实验原理:
盐析法
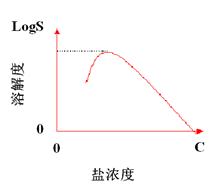
在蛋白质溶液中加入少量中性盐,蛋白质溶解度增加,称为盐溶;而加入大量中性盐达一定浓度,蛋白质就会沉淀,称为盐析。
原理 : ①大量盐加入后,能与蛋白质争夺水分子,去除水膜;
②大量盐能中和蛋白质分子表面电荷,使分子间静电斥力减弱,疏水作用增强,使蛋白质沉淀。
盐析效果: 二价离子 > 一价离子
离子半径小 > 离子半径大
阳离子∶Mg2+>Ca2+>Ba2+>NH4+>Na+>K+>Pb+>Cs+
阴离子∶PO43->SO42->Cl->Br->NO3->I->SCN-
蛋白质的溶解度与盐离子强度间的关系可以用Cohn经验式来表示:
式中:S—蛋白质的溶解度
I—离子强度
β—常数,与温度和pH有关
…… …… 余下全文
篇三 :《蛋白质盐析实验条件的探究》
蛋白质盐析实验条件的探究
黄秋静
广西师范大学化学与药学学院 桂林
摘要 对影响蛋白质盐析的实验条件进行了探究。认为其中三个主要影响因素为:鸡蛋清溶液的浓度、盐溶液种类、酸的加入顺序,最终总结得出蛋白质盐析实验的适宜条件。
关键字 蛋白质 盐析 实验条件
Inquiry experiment conditions of protein salting out
Huang-Qiujing
School of chemistry and pharmacy, Guangxi Normal University.Guilin,China
Abstract: The experimental conditions affecting protein salting out of the research. The three main factors: the egg white solution concentration, salt solution type, acid addition order, finally summarizes suitable conditions of protein salting out experiment.
Key word:protein salting out experiment condition
1 引言
在蛋白质溶液中加入一定浓度的强电解质盐,如(NH4)2 SO4 等,蛋白质从溶液中析出,这种作用称为盐析【1】。蛋白质盐析是高中阶段的重要演示实验,但实际操作中常常不能出现沉淀。盐析作用的实质是高浓度的强电解质破坏蛋白质分子表面的水化膜,同时电解质离子中和了蛋白质所带的电荷,蛋白质的稳定因素被消除,使蛋白质分子相互碰撞而凝聚沉淀【2】。蛋白质的溶解性受所带电荷和溶液离子强度的影响,而蛋白质所带电荷与溶液的pH有关,溶液离子强度与强电解质的无机盐自身性质有关。因此本文通过改变影响蛋白质溶解性的三个主要因素:鸡蛋清溶液的浓度、盐溶液种类、酸的加入顺序等进行蛋白质盐析实验的探究,以期寻找盐析实验的最佳反应条件。
…… …… 余下全文
篇四 :实验四 蛋白质纯化 盐析沉淀法
实验四 蛋白质纯化 盐析沉淀法
【实验目的】
采用硫酸铵盐析法将日本血吸虫谷胱甘肽硫转移酶融合蛋白从大肠杆菌BL21(DE3)pGEX-NS53细胞裂解液中分离出来,使学生学习掌握制备细胞裂解液的技术和采用盐析法从中分离目的蛋白质的技术。
【实验原理】
用盐析法从成分复杂的蛋白质溶液(如细胞裂解液)中提取目的蛋白质是一种传统的目前仍被广泛使用的蛋白质分离纯化技术。此种技术的工作原理如下:蛋白质在稀盐溶液中,其溶解度会随盐浓度的升高而增加,此种现象被称作盐溶。但是当盐的浓度继续增高时,蛋白质的溶解度又以不同程度地下降并先后从溶液中析出,此种现象被称为盐析。上述现象 是由于蛋白质分子中极性基团之间存在静电力。在低盐浓度下,蛋白质分子中极性基团之间的静电力受盐离子的影响而被消除,蛋白质在水中的极性基团的电荷被中和,水化膜被破坏,于是蛋白质分子之间相互聚集并从溶液中析出。盐析法就是根据不同蛋白质在一定浓度的盐溶液中溶解度降低程度的不同而达到彼此分离的方法。
盐析的一般操作步骤是,选择一定浓度范围的盐溶液(如0-25%饱和度的硫酸铵)使部分杂质呈“盐析”状态从溶液中沉淀出来,经离心法去除。而目的蛋白质呈盐溶状态,存在于上清中。增加盐浓度(如25-60%饱和度的NH4SO4)使目的蛋白质呈盐析状态,而从溶液中分离出来。
在盐析时,蛋白质的溶解度与溶液中离子强度的关系,可用下式表示: S lg = -Ks×I S0
式中的S为蛋白质在离子强度为I的溶解度,S0蛋白质在纯水(离强度为0)中的溶解度;KS为盐析常数。离子强度I可用下式表示:
I=1/2∑Z2
式中,M-溶液中各种离子克分子浓度
Z-各种离子所带的电荷数
在温度恒定时,S0对于某一种蛋白质在某一溶液中的溶解度是一个常数,lgS0也为一常数,以β代替,故式(1)可以改写为:
lgS=??Ks×I (3)
…… …… 余下全文
篇五 :蛋白质功能性质的检测实验报告
华南农业大学实验报告
专业班次 组别
题目 蛋白质功能性质的检测 姓 名 黄俊怡 日期 2015.07.11
一、实验目的
通过本实验定性地了解蛋白质的主要功能性质。
二、实验原理
蛋白质的功能性质一般是指能使蛋白质成为人们所需要的食品特征而具有的物理化学性质,即对食品的加工、贮藏、销售过程中发生作用的那些性质,这些性质对食品的质量和风味起着重要的作用。蛋白质的功能性质与蛋白质在食品体系中的用途有着十分密切的关系,是开发和有效利用蛋白质资源的重要依据。 蛋白质的功能性质可分为水化性质、表面性质、蛋白质-蛋白质相互作用的有关性质三个主要类型,主要包括有吸水性、溶解性、保水性、分散性、粘度和粘着性、乳化性、起泡性、凝胶作用等。
三、实验材料、试剂和仪器
1. 实验材料
(1) 2%蛋清蛋白溶液:取2g蛋清加98ml蒸馏水稀释,过滤取清夜。
(2) 卵黄蛋白:鸡蛋除蛋清后剩下的蛋黄捣碎。
2. 试剂
(1) 硫酸铵、饱和硫酸铵溶液
(2) 氯化钠、饱和氯化钠溶液
(3) 花生油
(4) 酒石酸
3. 仪器
(1) 刻度试管
(2) 100ml烧杯
(3) 冰箱
1
四、实验步骤
1. 蛋白质水溶性的测定
在10ml刻度试管中加入0.5ml蛋清蛋白,加入5ml水,摇匀,观察其水溶性,有无沉淀产生。在溶液中逐滴加入饱和氯化钠溶液,摇匀,得到澄清的蛋白质的氯化钠溶液。
取上述蛋白质的氯化钠溶液3ml,加入3ml饱和硫酸铵溶液,观察球蛋白的沉淀析出,再加入粉末硫酸铵至饱和,摇匀,观察清蛋白从溶液中析出,解释蛋清蛋白质在水中及氯化钠溶液中的溶解度以及蛋白质沉淀的原因。
2. 蛋白质乳化性的测定
取0.5ml卵黄蛋白于10ml刻度试管中,加入4.5ml水和5滴花生油;另取5ml水于10ml刻度试管中,加入5滴花生油;再将两支试管用力振摇2~3min,然后将两支试管放在试管架上,每隔15min观察一次,共观察4次,观察油水是否分离。
…… …… 余下全文
篇六 :蛋白质生化技术实验报告
蛋白质生化实验报告
生殖免疫研究所
薛樱子
学号:1133111003
实验一 溶液中蛋白质浓度的测定
一 光吸收法(测量范围:0.1—2mg)
1实验原理:由于蛋白质中存在着含有共轭双键的酪氨酸和色氨酸,它们具有吸收紫外光的性质,其吸收高峰在280nm波长处,且在此波长内吸收峰的光密度值OD280nm与其浓度成正比关系,故可作为蛋白质定量测定的依据。
纯蛋白的A280/A260为1.8,纯核酸的A280/A260为
2步骤:
2.1)打开仪器的电源开关(接220V交流电),打开比色槽暗箱盖,选择光源,选档,选波长,用调零旋钮调暗电流至0 。
2.2)将空白对照样品和待测溶液装入石英比色杯
2.3)将仪器的比色槽暗箱合上,比色槽处于蒸馏水(或校正缓冲液)校正位置,旋转光量调节器使电表指针正确处于0 。
2.4)拉出比色槽手柄拉杆使比色槽处于样品位置读数。
2. 5)在260nm和280nm分别读数(分别用缓冲液调0),根据上表查处相应蛋白浓度,根据喜事倍数计算原溶液蛋白浓度,根据体积计算总蛋白量。
3结果与分析:
A280=0.571 A260=0.340
根据公式:蛋白浓度=1.5 × A280 —0.75 × A260=1.5×0.571—0.75×0.340=0.6015
也可以根据蛋白质和核算含量折算图表画出一条直线估算蛋白质的浓度。
结果说明我的蛋白样品浓度是0.6015mg/ml。
二 Folin—酚法(测量范围:10-300ug/ml)
1实验原理:在碱性条件下,蛋白质中的肽键与铜结合生成复合物。 Folin—酚试剂中的磷钼酸盐—磷钨酸盐被蛋白质中的酪氨酸和苯丙氨酸残基还原,产生深蓝色(钼兰和钨兰的混合物)。在一定的条件下,蓝色深度与蛋白的量成正比。
…… …… 余下全文
篇七 :SCAU实验报告蛋白质功能性质的检测
蛋白质功能性质的检测
一、 实验目的
通过本实验定性地了解蛋白质的主要功能性质。
二、 实验原理
蛋白质的功能性质一般是指能使蛋白质成为人们所需要的食品特征而具有的物理化学性质,即对食品的加工、贮藏、销售过程中发生作用的那些性质,这些性质对食品的质量和风味起着重要的作用。蛋白质的功能性质与蛋白质在食品体系中的用途有着十分密切的关系,是开发和有效利用蛋白质资源的重要依据。
蛋白质的功能性质可分为水化性质、表面性质、蛋白质-蛋白质相互作用的有关性质三个主要类型,主要包括有吸水性、溶解性、保水性、分散性、粘度和粘着性、乳化性、起泡性、凝胶作用等。蛋白质的功能性质受多种因素影响,变化规律十分复杂。
三、 实验材料、试剂和仪器
1. 实验材料
(1) 2%蛋清蛋白溶液:取2g蛋清加98ml蒸馏水稀释,过滤取清夜。
(2) 卵黄蛋白:鸡蛋除蛋清后剩下的蛋黄捣碎。
2. 试剂
(1) 硫酸铵、饱和硫酸铵溶液
(2) 氯化钠、饱和氯化钠溶液
(3) 花生油
(4) 酒石酸
3. 仪器
(1) 刻度试管
(2) 100ml烧杯
(3) 冰箱
四、 操作步骤
1. 蛋白质水溶性的测定
在10ml刻度试管中加入0.5ml蛋清蛋白,加入5ml水,摇匀,观察其水溶性,有无沉淀产生。在溶液中逐滴加入饱和氯化钠溶液,摇匀,得到澄清的蛋白质的氯化钠溶液。
取上述蛋白质的氯化钠溶液3ml,加入3ml饱和硫酸铵溶液,观察球蛋白的沉淀析出,再加入粉末硫酸铵至饱和,摇匀,观察清蛋白从溶液中析出,解释蛋清蛋白质在水中及氯化钠溶液中的溶解度以及蛋白质沉淀的原因。
…… …… 余下全文
篇八 :藻蓝蛋白 实验报告
藻蓝蛋白的分离与纯化
姓名:郭均
学院:食品与生物工程
班级:食安 09-2
学号:200906041069
藻蓝蛋白的分离与纯化
一、 实验目的和要求
1、了解藻蓝蛋白的生理意义及功能,藻蓝蛋白的一般提取和纯化的方法;
2、掌握蛋白含量测定方法;
3、掌握盐析和离子交换层析纯化蛋白的分析技术。
二、实验原理
藻蓝蛋白(PC)是一类普遍存在于藻蓝蛋白中的光合辅助色素,也是一种天天然色素蛋白,具有水溶性,可用作视频着色剂。此外,它具有强烈的荧光,在分子生物学上被制成荧光探针,是一种无毒、无副作用的理想光敏剂。藻蓝蛋白还具有重要的医疗价值,不但能提高机体的非特异性免疫功能,而且对特异性免疫功能有促进作用。另外它还有清除自由基的能力,可以抗疲劳,延缓衰老,对人体的生理功能有重要的生物学意义。
利用盐析沉淀蛋白质的基本原理:盐在水溶液中电离所形成的正负离子可吸收水分子,从而夺取蛋白质分子上的水化膜,还可以中和部分电荷,致使蛋白质聚集,从而达到盐析沉淀蛋白质的目的。由于各种蛋白颗粒大小、所带电荷的多少及亲水程度不同,当使用某种中性盐对其进行盐析时,所需的最低盐浓度各不相同。研究表明可用25%硫酸铵饱和度沉淀除去杂质,55%硫酸铵沉淀藻蓝蛋白。盐析出来的蛋白质,需通过脱盐以除去硫酸铵等盐类物质。最常用脱盐的方法是透析。蛋白质是大分子物质,它不能透过半透膜,故不断更换蒸馏水或缓冲液可将盐类等小分子杂志透析掉。
蛋白质含量测定有紫外分光光度计法和显色法(Folin-酚法、考马斯亮蓝法等),本实验采用考马斯亮蓝法测定提取藻蓝蛋白的含量,考马斯亮蓝G-250在酸性溶液中为棕红色,当它与蛋白质通过疏水作用后变为蓝色,最大光吸收由465nm变为595nm,在一定范围内,蛋白质含量与595nm处吸光值成正比。
离子交换层析法纯化蛋白质,常用的阳离子交换剂有弱酸性的羧甲基纤维素(CM纤维素),阴离子交换剂有弱碱性的二乙胺基乙基纤维素(DEAE-纤维素)。蛋白质的混合物与纤维素离子的交换剂的酸性基团或碱性基团结合,结合力的大小取决于彼此间相反基团的静电引力,这又与溶液的pH有关,因为pH决定离子交换剂和蛋白质的解离程度。盐类的存在可以降低离子交换剂的解离基团与蛋白质相反电荷之间的静电引力。因此,被吸附的蛋白质的洗脱通过改变pH或离子强度来实现,与离子交换剂结合力小的蛋白质先从层析柱中洗脱下来。
…… …… 余下全文

推荐阅读
猜你喜欢
