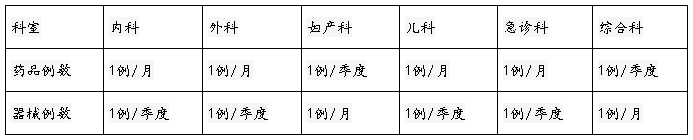
附表1 制表单位:国家食品药品监督管理局
药品不良反应 / 事件报告表
新的□严重□一般□ 医疗卫生机构□ 生产企业经营企业□ 个人□ 编码□□□□□□□□□□□□□□□□□□□
单位名称:合肥市三院 部门: 电话: 报告日期: 年 月
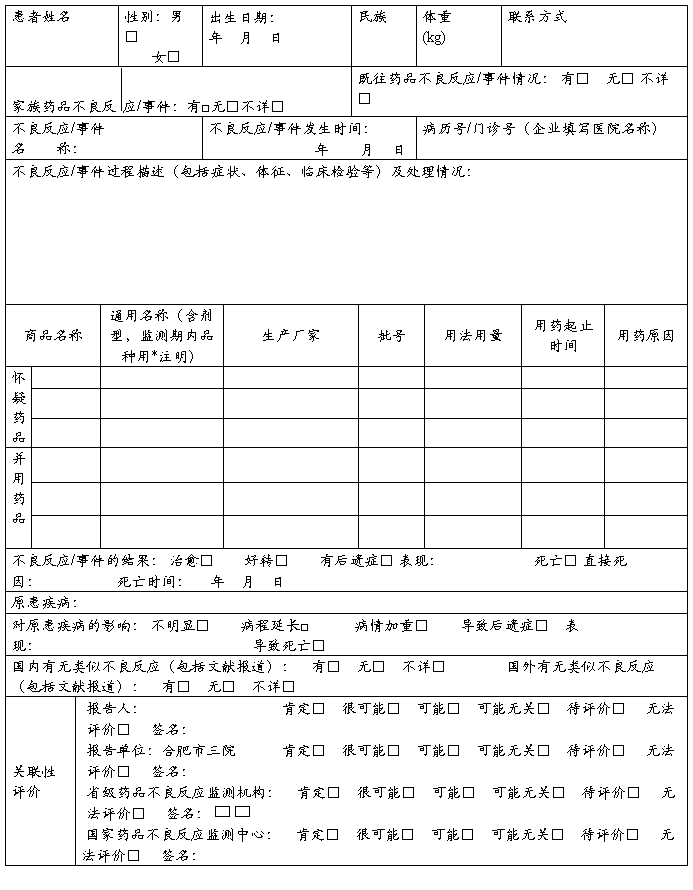
报告人职业(医疗机构):医生□ 药师□ 护士□ 其他□ 报告人职务职称(企业): 报告人签名:
◇不良反应/事件分析

◇严重药品不良反应/事件是指有下列情形之一者:
① 引起死亡 □
② 致畸、致癌或出生缺陷 □
③ 对生命有危险并能够导致人体永久的或显著的伤残 □
④ 对器官功能产生永久损伤 □
⑤ 导致住院或住院时间延长 □
◇编码规则:
省(自治区、直辖市) 市(地区) 县(区) 单位 年代 流水号
□□ □□ □□ □□□□ □□□□ □□□□□
注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和国行政区划代码填写。
单位编码第一位如下填写:医疗机构1、军队医院2、计生机构3、生产企业4、经营企业5。
个人报告单位编码一栏填写6000
◇注:通用名称一栏,首次获准进口5年内的进口品种用*注明
国家药品不良反应监测中心 _______药品不良反应监测中心
…… …… 余下全文