氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定
一.实验目的:1.培养同学们“通过实验手段用已知测未知”的实验思想。
2.学习相关仪器的使用方法,掌握酸碱滴定的原理及操作步骤.
3.实现学习与实践相结合。
二.实验仪器及药品:
仪器:滴定台一台,25mL酸(碱)滴定管各一支,10mL移液管一支,250mL锥形瓶两个。
药品:0.1mol/L NaOH溶液,0.1mol/L盐酸,0.05mol/L草酸(二水草酸),酚酞试剂,甲基橙试剂。
三.实验原理:中和滴定是酸与碱相互作用生成盐和水的反应,通过实验手段,用已知测未知。即用已知浓度的酸(碱)溶液完全中和未知浓度的碱(酸)溶液,测定出二者的体积,然后根据化学方程式中二者的化学计量数,求出未知溶液的浓度。酸碱滴定通常用盐酸溶液和氢氧化钠溶液做标准溶液,但是,由于浓盐酸易挥发,氢氧化钠易吸收空气中的水和二氧化碳,故不能直接配制成准确浓度的溶液,一般先配制成近似浓度溶液,再用基准物标定。本实验用草酸(二水草酸)作基准物。
⑴氢氧化钠溶液标定:H2C2O4+2NaOH=Na2C2O4+2H2O
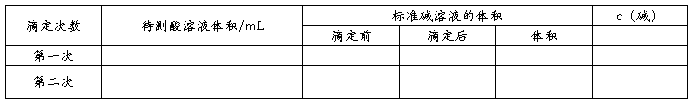
反应达到终点时,溶液呈弱碱性,用酚酞作指示剂。(平行滴定两次)
⑵盐酸溶液标定:HCl+NaOH=NaCl+H2O
反应达到终点时,溶液呈弱酸性,用甲基橙作指示剂。(平行滴定两次)
四.实验内容及步骤:
1.仪器检漏:对酸(碱)滴定管进行检漏
2.仪器洗涤:按要求洗涤滴定管及锥形瓶,并对滴定管进行润洗
3.用移液管向两个锥形瓶中分别加入10.00mL草酸(二水草酸),再分别滴入两滴酚酞.向碱式滴定管中加入药品至零刻线以上,排尽气泡,调整液面至零刻线,记录读数。
…… …… 余下全文

 C2O4+2NaOH=Na2C2O4+2H2O
C2O4+2NaOH=Na2C2O4+2H2O