化学学生实验报告
班级: 组长: 合作者:
时间: 实验名称:
一、实验目的:
1、 明确指示剂在酸碱性不同的情况下呈现不同的颜色;
2、 酸碱盐彼此之间发生反应的现象;
3、 锻炼实验操作能力,学会用指示剂来检测酸碱盐发生反应时溶液的酸碱性变化情况;
4、 能用所学知识,分析解决实际问题。
…… …… 余下全文
化学学生实验报告
班级: 组长: 合作者:
时间: 实验名称:
一、实验目的:
1、 明确指示剂在酸碱性不同的情况下呈现不同的颜色;
2、 酸碱盐彼此之间发生反应的现象;
3、 锻炼实验操作能力,学会用指示剂来检测酸碱盐发生反应时溶液的酸碱性变化情况;
4、 能用所学知识,分析解决实际问题。
…… …… 余下全文
《溶液的酸碱性》、《酸与碱的化学性质》
实验目的:
1.了解酸碱指示剂(石蕊、酚酞)在pH不同的溶液中所呈现的颜色;
2.学会使用指示剂检验溶液酸碱性的基本方法和实验操作;
3.学会使用pH试纸测定溶液pH人基本方法和实验操作。
4.比较常见酸的化学性质,认识其特征;
5.认识觉碱的一些化学性质;
6.通过探究,认识酸碱中和反应。
实验用品:
稀盐酸、稀氢氧化钠溶液、食盐水、紫色石蕊试液、无色酚酞试液、硫酸铜溶液、锌粒、铜片、生锈铁钉、石灰石
酒精灯、烧杯、胶头滴管、试管、试管夹、pH试纸、玻璃棒、表面皿、镊子
实验过程:
1.常见指示剂在酸、碱溶液中的显色
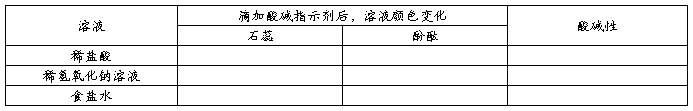
在小试管中分别倒入少量稀盐酸、氢氧化钠溶液、食盐水,再各滴加1~2滴石蕊(酚酞)试液,观察颜色的变化,完成下表:
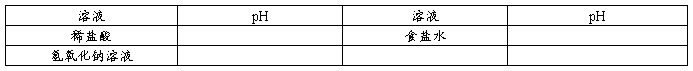
2.pH试纸的使用
取1张pH试纸,将试纸放在表面皿上,用干净的玻璃有机会蘸取少许待测液于pH试纸上,将试纸呈现的颜色与标准比色卡对照,读取标准比色卡上与pH试纸最相近颜色对应的pH,定为待测液的pH。
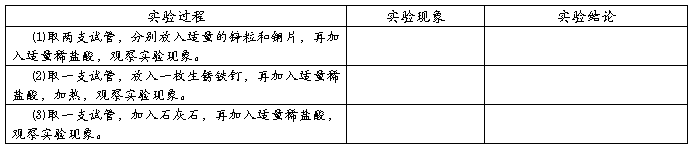
3.常见酸的化学性质:
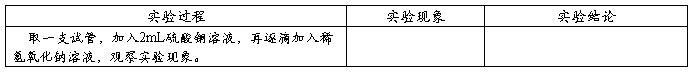
4.常见碱的化学性质:
5.酸碱中和反应

问题讨论:
1.使用pH试纸测定溶液的pH时,试纸是否要先润湿?请说明理由。
2.思考:若用润湿的pH试纸测定酸性溶液pH,测定结果比实际结果如何?测定碱性溶液的pH呢?
4.用稀硫酸除去铁制品表面的铁锈,是否能将铁制品长期浸泡在酸溶液中?为什么?写出相关的化学方程式。
5.酸碱中和反应实验中,步骤⑶的目的是什么?
…… …… 余下全文
化学实验报告------酸碱盐性质
班级 姓名
一、酸碱指示剂
1.取两只试管分别加入1-2ml稀硫酸,各自滴加2-3滴紫色石蕊试液和无色酚酞试液。石蕊 酚酞
2.取两只试管分别加入1-2ml氢氧化钠溶液,各自滴加2-3滴紫色石蕊试液和无色酚酞试液。石蕊 酚酞
结论:石蕊 酚酞
3、测定稀硝酸、石灰水、碳酸钠溶液的pH
用玻璃棒蘸取少量待测液体,涂在试纸上,然后和标准比色卡比对
稀硝酸的pH= 石灰水的pH= 碳酸钠溶液的pH=
…… …… 余下全文
化学实验报告------酸碱盐及金属的化学性质
一、知识回顾
1.酸具有相似的化学性质是因为它们的水溶液中都含有 离子;
2.碱具有相似的化学性质是因为它们的水溶液中都含有 离子;
3.酸和碱发生中和反应的实质是 。
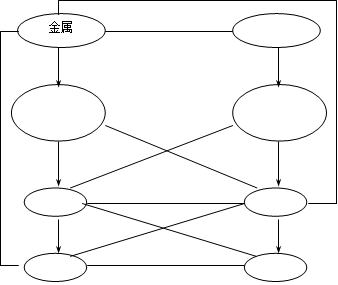 4、金属活动顺序 。
4、金属活动顺序 。
5、
二、酸碱指示剂
1.取两只试管分别加入1-2ml稀硫酸,各自滴加2-3滴紫色石蕊试液和无色酚酞试液。石蕊 酚酞
2.取两只试管分别加入1-2ml氢氧化钠溶液,各自滴加2-3滴紫色石蕊试液和无色酚酞试液。石蕊 酚酞
…… …… 余下全文
有关酸碱盐的实验设计
姓名____________班级__________
必做题(100分)
1、某校附近有一条黑臭的小河。校环保小组为让学生认识和分析小河污染的原因,做了以下实验:取4只烧杯,分别盛有50mL水,向烧杯中分别加入相同量的盐酸、氢氧化钠、食盐和牛奶。一周后,有一只烧杯中出现了黑臭的现象,该烧杯中加入的物质是( )
A.盐酸 B.氢氧化钠 C.食盐 D.牛奶
2、为了鉴别一桶实验室用的蒸馏水是否被某种酸污染,采用了下列几种方法中不可取的是( )
A.取样品向其中滴入石蕊试液 B.测定样品的密度
C.取样品用嘴品尝 D.试验样品的导电性
3、为了除去粗盐中的Na2SO4、MgCl2、CaCl2,得到较纯净的食盐,可用下列操作:①过滤;②加过量的NaOH溶液;③加热蒸发得到晶体;④加水溶解;⑤加过量的盐酸;⑥加过量的Na2CO3溶液;⑦加过量的BaCl2溶液。正确的操作顺序是( )
…… …… 余下全文
氢氧化钠溶液的标定及盐酸溶液对氢氧化钠溶液的滴定
一.实验目的:
1.培养同学们“通过实验手段用已知测未知”的实验思想。
2.学习相关仪器的使用方法,掌握酸碱滴定的原理及操作步骤.
3.实现学习与实践相结合。
二.实验仪器及药品:
仪器:滴定台一台,25mL酸(碱)滴定管各一支,10mL移液管一支,250mL锥形瓶两个。
药品:0.1mol/L NaOH溶液,0.1mol/L盐酸,0.05mol/L草酸(二水草酸),酚酞试剂,甲基橙试剂。
三.实验原理:中和滴定是酸与碱相互作用生成盐和水的反应,通过实验手段,用已知测未知。即用已知浓度的酸(碱)溶液完全中和未知浓度的碱(酸)溶液,测定出二者的体积,然后根据化学方程式中二者的化学计量数,求出未知溶液的浓度。酸碱滴定通常用盐酸溶液和氢氧化钠溶液做标准溶液,但是,由于浓盐酸易挥发,氢氧化钠易吸收空气中的水和二氧化碳,故不能直接配制成准确浓度的溶液,一般先配制成近似浓度溶液,再用基准物标定。本实验用草酸(二水草酸)作基准物。
(1)氢氧化钠溶液标定:H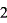 C2O4+2NaOH=Na2C2O4+2H2O
C2O4+2NaOH=Na2C2O4+2H2O
反应达到终点时,溶液呈弱碱性,用酚酞作指示剂。(平行滴定两次)
(2)盐酸溶液标定:HCl+NaOH=NaCl+H2O
反应达到终点时,溶液呈弱酸性,用甲基橙作指示剂。(平行滴定两次)
四.实验内容及步骤:
1.仪器检漏:对酸(碱)滴定管进行检漏
2.仪器洗涤:按要求洗涤滴定管及锥形瓶,并对滴定管进行润洗
3.用移液管向两个锥形瓶中分别加入10.00mL草酸(二水草酸),再分别滴入两滴酚酞.向碱式滴定管中加入药品至零刻线以上,排尽气泡,调整液面至零刻线,记录读数。
4.用氢氧化钠溶液滴定草酸(二水草酸)溶液,沿同一个方向按圆周摇动锥形瓶,待溶液由无色变成粉红色,保持30秒不褪色,即可认为达到终点,记录读数。
…… …… 余下全文
课题:酸碱指示剂及PH试纸的使用
授课班级:九年级(1)班 授课教师:
课 型:实验课 授课地点:实验室
教学目标:
①知识能力目标:
明确指示剂(石蕊、 酚酞)遇酸碱时会呈现不同的颜色;
知道变色的物质是指示剂而不是酸和碱;
学会用PH试纸测溶液的PH值。
②过程与方法:
通过对指示剂,PH试纸使用的方法及相关实验操作的回顾,完成相关实验;通过对实验的操作,培养学生学习化学的方法;通过对实际问题中化学现象的解释,激发学生学习化学的兴趣。
③情感态度价值观:
锻炼实验操作能力;
能用所学知识,分析解决实际问题。
教学重点:
锻炼实验操作能力,激发学生学习化学的兴趣。
教学难点:
提取实验数据,培养学生学习化学的方法
教学内容:
1、 知识链接:
a、酸碱指示剂:
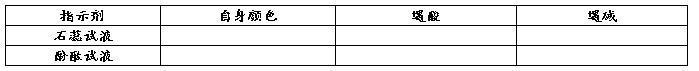
b、PH值的范围: 。
…… …… 余下全文
