质管字2009 22
换发《医疗器械经营企业许可证》
现场检查整改报告
呼和浩特市食品药品监督管理局:
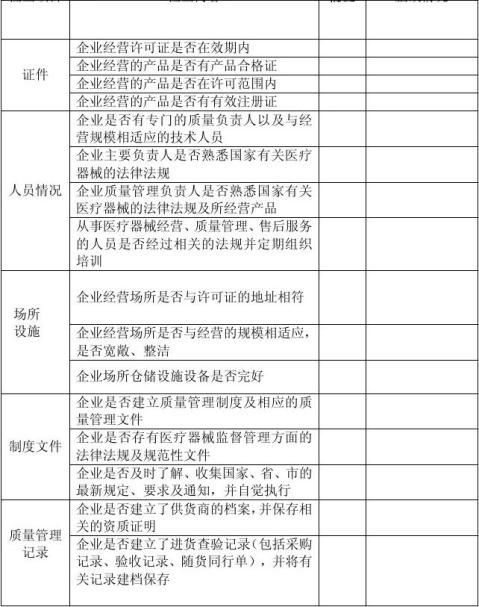
二〇〇九年十一月二日贵局对我公司进行了换发《医疗器械经营企业许可证》现场检查,根据《呼和浩特市医疗器械兼营企业现场检查验收标准》,审查组对我公司存在的问题提出了如下整改意见:
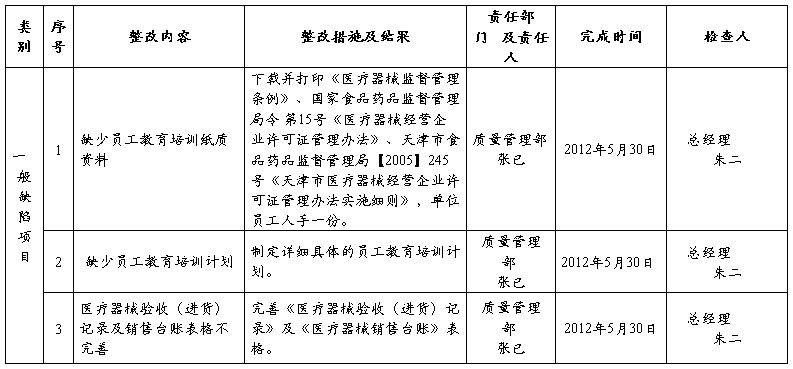
1、规范各项制度内容;
2、完善记录并健全记录;
4、加强相关法规的培训并做好记录。
根据审查组提出的整改意见,我公司及时组织相关人员进行了整改工作,现将整改措施和整改后情况汇报如下;
1、我公司已经组织相关人员,对《医疗器械质量管理体系文件汇编》,进行了修订充实,现已重新整理装订成册,下发到各个部门。
2、根据要求医疗器械的质量记录与药品质量记录进行了分离,医疗器
械经营过程中各项记录做到了单独填写、单独保存归档。
3、我公司质量管理部已经组织公司全体员工,结合实际情况对医疗器
械相关法律、法规进行了学习,并做好了学习记录。
以上是我公司根据审查组提出的问题所做的整改工作,有贵局对我们
经营管理工作的大力支持,一定会把医疗器械经营质量管理工作做得更好。
呼和浩特市福瑞药业有限责任公司
二○○九年十一月四日
主题词:换发许可证 整改报告 呈 送:内蒙古自治区食品药品监督管理局 呼和浩特市食品药品监督管理局 呼和浩特市福瑞药业有限责任公司 2009.11.04
…… …… 余下全文