工艺验证方案内容
封页:验证题目、文件编号和方案审批
1、目的
2、范围
3、职责分工与 时间计划
4、概述
4.1 将要使用的验证方法的描述(如:前验证、同步验证、回顾性验证),并带有对所选方法的理由说明;
4.2 产品描述(包括产品名称、剂型、适用剂量;工艺规程及待验证基准批记录的版本;最终产品的标准;中间过程控制标准;原辅料清单:检验标准、物料代码等;已有药品的相等性)
4.3 过程流程图表说明关键过程步骤以及关键过程的监控参数;
5、验证前的检查;
5.1 验证所需文件的确认
5.1.1 人员培训的确认
5.1.2 参与验证的设备和设施列表;及设备设施的确认(包括关键生产设备、净化空调系统、水系统、压缩空气等)
5.1.3 仪器仪表校验的确认(所有用于验证的测试设备仪表都应该在校验有效期内)
6、验证内容
6.1 关键过程参数和操作范围(包括对其范围的理由说明或包含理由说明的其他参考文件)
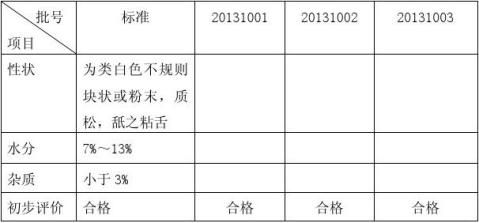
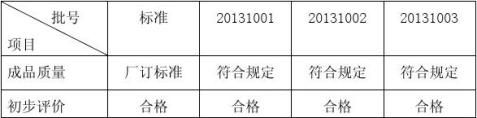
6.2 可接受标准及检测方法;
6.3 取样计划(包括取样的时间、形式、位置、工具、量和样品数、编号原则等)
6.4 稳定性测试(若无要求,方案须包含对这一决定的评估理由)
7、记录和评估结果的方法(如:统计分析)
工艺验证报告内容
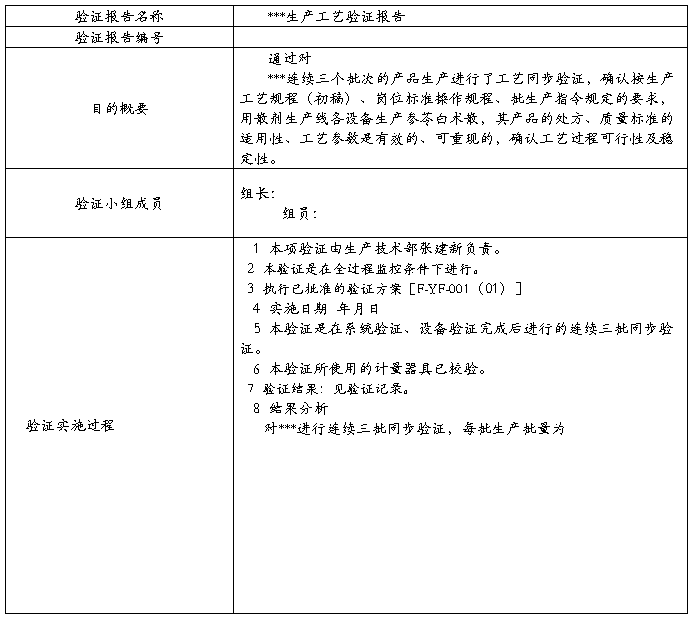
封页:验证题目、文件编号和报告审批;
1、验证目的和范围;
2、实验实施的描述;
3、结果总结;
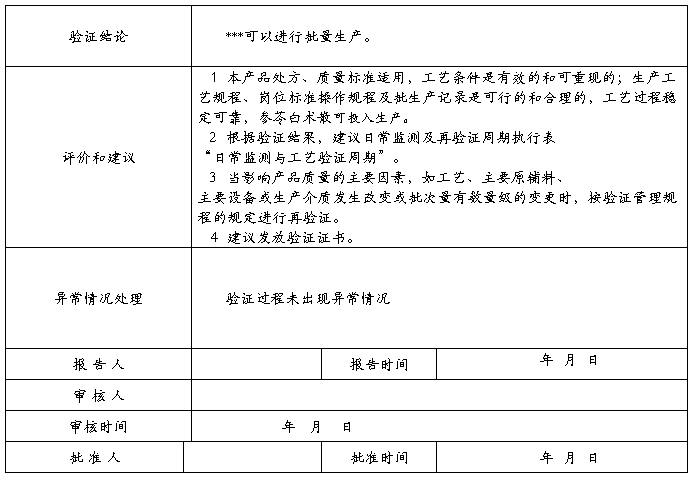
4、结果分析;
5、结论;
6、偏差和纠正措施;
7、附件(包括原始数据);
8、参考资料(包括验证方案文件编号和版本号);
9、对需要纠正缺陷的建议。
…… …… 余下全文