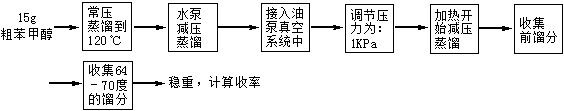
实验六 减压蒸馏
一、实验目的
1、学习减压蒸馏的原理及其应用
2、掌握减压蒸馏仪器的安装及其操作技术
二、预习要求
理解减压蒸馏的定义;了解减压蒸馏的用途及适用范围;了解各种泵的减压效率;巩固有机实验装置搭配顺序;掌握测压计的使用;思考在本实验中如何防止汞中毒、玻璃仪器炸裂、倒吸等实验事故的发生。
三、实验原理
减压蒸馏,顾名思义就是减少蒸馏系统内的压力,以降低其沸点来达到蒸馏纯化的目的的蒸馏操作。实验证明:当压力降低到10~15毫米汞柱(1.3~2.0kPa)时,许多有机化合物的沸点可以比其常压下的沸点降低80~100℃。因此,减压蒸馏对于分离或提纯沸点较高或者性质比较不稳定的液态有机化合物具有特别重要的意义。因为这类有机化合物往往加热未到沸点即已分解、氧化、聚合,或者其沸点很高很难达到,而采用减压蒸馏就可以避免这种现象的发生。所以,减压蒸馏也是分离、提纯液态有机物常用的方法。
减压蒸馏亦称真空蒸馏,一般把低于101.3kPa压力的气态空间称为真空,因此真空在程度上有很大的差别。
在减压蒸馏实验前,应先从文献中查阅该化合物在所选压力下相应的沸点。如果缺乏此数据,常用下述经验规律大致推算,仅供参考。
当蒸馏在1333~1999Pa(10~15mmHg)下进行时,压力每相差133.3Pa(1 mmHg)沸点相差约1℃。在实际减压蒸馏中,可以参阅图6-1,估计一个化合物的沸点与压力的关系,从某一压力下的沸点可推算另一压力下的沸点(近似值)。
例如,常压下沸点为250℃的某有机物,减压到10mmHg时沸点应该是多少?可先从上图B线(中间的直线)上找出250℃的沸点,将此点与C线(右边直线)上的10mmHg的点连成一直线,延长此直线与A线(左边的直线)相交,交点所示的温度就是10mmHg时的该有机物的沸点,约为110℃。此沸点,虽然为估计值,但较为简便,有一定参考价值。
…… …… 余下全文