卤素离子的分离及检出讨论报告
完成日期:20xx年11月11日
作者:吴亦歌 刘春宏 刘树青 刘薇 徐璐颖 戴安婧
生命科学学院
指导老师:王睿博
一、 摘要
讨论了利用连续法进行氯离子、溴离子和碘离子的分离和检出时控制条件对实验结果的影响,设计了验证实验。总结了本实验所用分离方法,说明其原理和适用范围。
二、 前言
物质的分离、提纯和成分分析是化学学科的一个重要领域。在进行成分分析时,由于离子或分子间存在相互干扰的现象,因此在成分分析前,分离、检出就显得尤为重要。本次实验,我们小组就利用连续法进行氯离子、溴离子和碘离子的分离和检出时控制条件对实验结果的影响进行了讨论与研究,并总结了本实验中所用的分离方法,阐述其原理和适用范围。
三、 内容
㈠我们小组将题中所说的“条件”分为内部条件与外部条件(此处的分类只为了讨论方便,无严格界限),分别进行了总结归纳:
(1) 内部条件:
内部条件是指试验中试剂的浓度、纯度等,有:
? 混合液中溴离子、氯离子、碘离子的浓度的相对多少:
当溶液中氯离子过多时,在用氨水溶解氯化银时,可能会使少量的碘化银和溴化银溶解(氨水所加量过多导致溶解),导致分离不完全,对氯离子的检验造成一定干扰。(计算见下)
当溶液中碘离子远多于溴离子时,首先是将碘离子氧化为碘酸根所需氯水的量较大,可能无法完全转化,且使溴离子检出的现象不明显;溴离子过少,同上,将其转化溴单质后,溶在有机层中颜色不明显,导致漏检溴离子。
实际中,一部分同学在观察到碘单质溶于四氯化碳后,滴加很多滴氯水无法观察溴单质的颜色,在吸出部分碘的四氯化碳溶液后才成功观察到溴单质的橙色,这一事实说明了以上几点。
? 溶解氯化银时所加氨水的浓度:
本实验中,所加氨水浓度为2mol/L,此时仅氯化银溶于其中。那么,溴化银、碘化
银绝对不溶于氨水么?
对于反应
AgBr+2NH3*H2O=Ag(NH3)2Br+2H2O
…… …… 余下全文



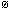 A(HIO3 /I2 ) > E
A(HIO3 /I2 ) > E 四川化工职业技术学院
四川化工职业技术学院
 西安交通大学化学实验报告
西安交通大学化学实验报告 在一个圆底烧瓶里先盛小半瓶水,加热使水的温度上升至沸腾,用带玻璃的塞子塞紧瓶口,然后将烧瓶倒置,放置在铁架台上,使玻璃管放进盛有石蕊的
在一个圆底烧瓶里先盛小半瓶水,加热使水的温度上升至沸腾,用带玻璃的塞子塞紧瓶口,然后将烧瓶倒置,放置在铁架台上,使玻璃管放进盛有石蕊的
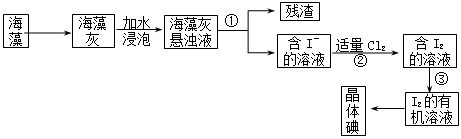 海藻中含有丰富的碘元素(设以I―形式)。某学生课外活动小组设计从海藻中提取碘的流程如下:
海藻中含有丰富的碘元素(设以I―形式)。某学生课外活动小组设计从海藻中提取碘的流程如下: